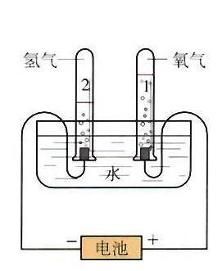
實驗裝置
水分子 H2O
氧分子 O2
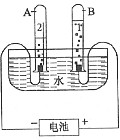 A試管里為氫氣,B試管里為氧氣。
A試管里為氫氣,B試管里為氧氣。【為增強水的電解性,可在水中加入少量稀硫酸、氫氧化鈉溶液(一般不加氫氧化鈉溶液,容易起泡沫)、硫酸鈉溶液、硝酸鉀溶液等】二氧化碳可以用來滅火。
電極(陽極必須為惰性電極,否則電極溶解而收集不到氧氣,可以用鉛電極)
實驗現象
試管內有氣泡,與電源正極(氧氣),負極(氫氣)相連的試管產生的氣體比值:1:2(熟記口訣:氫二氧一,陽氧陰氫)
但在一般情況下,氫氣與氧氣的體積比值一般大於2:1,原因有下面兩種 :
1.氫氣和氧氣的溶解性的差別,氫氣難溶於水,氧氣不易溶於水(1L水30mL的氧氣)但一小部分氧氣溶於水,比值大於2:1.
2.電極氧化消耗了一部分氧氣
ρO2=1.429g/mL , ρH2=0.089g/mL
(其中氫,氧兩種分子數比值:2:1;氫氣,氧氣的質量比值:1:8;氫元素和氧元素的體積比:2:1)
有八個字簡單概括是:正氧負氫。氫二氧一。
上述實驗中發生的化學反應屬於分解反應。
在上圖的裝置里,我們可以知道氫氣多的是負極,少的則是氧氣。氫多氧少
方程式
 方程式
方程式符號表達式:
(通電)
文字表達式:水→氫氣+氧氣
結論
水由氫、氧兩種元素組成。(注意:電解水實驗是產生氫氣和氧氣,不能說水由氫氣和氧氣組成,兩者是不能相互交換的)
水(分子)中,氫、氧兩種元素的原子個數比為2:1,分子個數比2:1體積比為2:1 質量之比為1:8
水通電生成氫氣、氧氣。
正極產生的是氧氣,負極產生的是氫氣。
化學反應前後,元素種類不變。
在化學變化中,分子可分成原子,而原子不可分,可構成新的分子。
有時實驗結果不準確,原因如下:
1、氫氣與氧氣在水中的溶解度不同;
2、氣體在電解器壁上的附著程度不同;
3、有副反應發生,消耗氧氣。
注意事項
⒈純水不導電,可在水中加入少量硫酸鈉或氫氧化鈉或稀硫酸增強導電性。
⒉在實驗進程剛開始時,氧氣和氫氣的體積比與1:2不符,是因為氧氣不易溶於水,但會溶解一小部分;氫氣難溶,反應速率較慢,所以氫氣較少。
3.一定要將電解槽中的空氣排盡,關閉活塞。
如何驗證
如用排氣法收集,則要用拇指堵住試管口一會兒,(試管口朝下)使試管內可能尚未熄滅的火焰熄滅,收集好後,用大拇指堵住試管口移近火焰再移開,聲音很小則表明氫氣很純。如果聽到尖銳的爆鳴聲,表明氫氣不純。這時需要重新收集和檢驗。氫氣能夠燃燒,可用燃燒著的小木條檢驗氫氣,氫氣燃燒時發出淡藍色火焰,可能你會看見是黃色火焰,是因為裝有氫氣的容器中含有其他的化學物質,一般是元素鈉的黃色。
如何區分
能使帶火星的木條復燃的是氧氣,氫氣可用燃著的木條。氫氣燃燒會產生淡藍色的火焰。(如果氫氣太少可能只會有“撲”一聲,不會燃燒)
口訣
正氧、負氫(爭養父親)正氧體小能助燃;負氫體大能燃燒。