臨床表現
 |
| 急性淋巴細胞白血病症狀 |
老年人急性淋巴細胞白血病有4方面的臨床表現,即貧血、發熱、出血及浸潤。起病症狀可隱匿、緩慢,亦可急驟。
1.貧血是由於骨髓紅系細胞的增殖受抑,部分病例存在紅細胞壽命的縮短,以及出血等亦是導致貧血的原因,當然在套用化學治療後,藥物抑制了紅系細胞的增殖,又可加重貧血症狀。
2.發熱半數的患者以發熱為早期表現。可低熱,亦可高達39~40℃以上,伴畏寒、出汗等。雖然白血病本身可以發熱,但較高熱往往提示有繼發感染。導致感染的原因是機體免疫功能的低下,包括正常白細胞增殖的受抑,粒細胞減少,細胞免疫功能低下等,當患者進行化學治療後,包括套用腎上腺皮質激素後更易患感染。常見的感染為上呼吸道感染,其中以口腔炎最多見。齒齦炎或咽峽炎,嚴重時可發生潰瘍甚至壞死。此外,肺炎、腸炎、腎盂腎炎、肛周炎、癤腫也較常見。嚴重感染可並發菌血症或敗血症。有些患者可有發熱而找不到感染灶。白血病開始階段的感染多數是細菌感染,尤其是革蘭陰性桿菌感染,後期病例往往夾雜真菌感染,或是細菌的混合感染。後期病例可見肺孢子蟲感染及巨細胞病毒感染。
3.出血出血的原因主要是血小板減少,血小板減少的原因是由於骨髓巨核細胞增殖受抑,其次是白血病細胞的血管壁浸潤,部分並發彌散性血管內凝血者則出現明顯的出血症狀,化學治療後由於同時抑制了巨核細胞的增殖會加重出血症狀。出血最嚴重的是顱內出血,顱內出血者常伴有顱內白血病細胞浸潤,常是白血病致死的原因之一。有資料表明急性白血病死於出血者占62.24%,其中87%為顱內出血。
4.器官和組織浸潤的表現白血病細胞可有多臟器的浸潤,出現不同的浸潤症狀:
(1)多見的是骨髓的浸潤出現胸骨壓痛,骨及關節的浸潤出現疼痛症狀,少數病例的骨痛症狀是由於白血病骨髓壞死所致。
(2)淋巴結、肝、脾的浸潤可出現不同程度的腫大。較急非淋常見,各約占75%、85%、78%。
(3)約有10%的病例在起病時即有頭痛、噁心、嘔吐,已有中樞神經系統白血病的表現。腦脊髓膜浸潤出現腦膜白血病是中樞神經系統白血病浸潤的常見類型,中樞神經系統白血病(CNS-L)還可表現為腦實質的浸潤以及脊髓的浸潤,根據不同部位可出現相應的定位體徵。
(4)皮膚浸潤在急淋中並不多見,若有皮膚累及者,多系早期B細胞表型者。
(5)睪丸受浸潤,出現無痛性腫大,多為一側性,另一側雖不腫大,但活檢時往往也有白血病細胞浸潤。睪丸白血病多見於急淋白血病化療緩解後的男性幼兒或青年,是僅次於CNS-L的白血病髓外復發的根源。
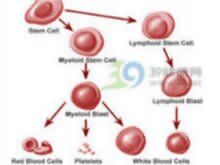
 分子物學
分子物學(1)FAB形態學分類:急淋分為3個亞型L1,L2,L3。
(2)免疫學分類:
①B細胞的免疫表達早期前B細胞示HLA-DR,TdT(末端脫氧核苷酸轉移酶),CD34,CD19,CD24,CD10(CALLA)等陽性;前B細胞示HLA-DR,CD19,CD24,CD10,CD20、Cμ(胞漿重鏈)陽性,B細胞示HLA-DR,CD19,CD24,CD10,C20,CIg,C21陽性。
②T細胞的免疫表達T細胞抗原CD7是最敏感的,但有的T細胞急淋者會示陰性結果,因此須加測CD5及CD2。兒童T細胞急淋很少表達HLA-DR陽性。CD3常示胞質陽性及表面陰性。
(3)細胞遺傳學分類:急淋的染色體改變:前B細胞急淋t(1;19);B細胞急淋t(8;14)、t(2;8)、t(8;22);T細胞急淋t(11;14)、t(1;14)、t(8;14)、t(10;14)、t(7;9)、t(7;14)、INV(14)。此外尚可在急淋中有t(9;22),常為預後欠佳的染色體改變。
(4)分子生物學:隨著分子生物學技術的不斷發展,如PCR、FISH和原位PCR基因診斷技術,有些白血病患者未發現有染色體異常,但基因診斷技術可發現異常的融合基因;如t(8;14)(q24;q32)的myc與免疫球蛋白(Ig)基因融合、t(1;19)(q23;p13)的E2A與PBX基因融合、t(1;14)(p32;q11)的SCL(TAL-1)與TCR基因融合、t(10;14)(q24;q11)的HOX-11與TCR基因融合、t(11;14)(q13;q32)的BCL-1與Ig基因融合和t(14;18)(q32;q21)的BCL-2與Ig基因融合。這些融合基因常常與急淋有關。
發病原因
 |
| 老年人急性淋巴細胞白血病病因 |
白血病的病因尚未完全闡明。較為公認的因素有:
①電離輻射:接受X線診斷與治療、32P治療、核子彈爆炸的人群白血病發生率高;
②化學因素:苯及其衍生物、抗腫瘤藥如烷化劑和足葉乙甙、治療銀屑病的乙雙嗎啉等均可引起白血病,特別是ANLL;③病毒:如一種C型反轉錄病毒——人類T淋巴細胞病毒-I可引起成人T細胞白血病;④遺傳因素:家族性白血病占白血病的0.7%,同卵雙生同患白血病的幾率較其他人群高3倍,B細胞慢性淋巴細胞白血病呈家族性傾向,先天性疾病如Fanconi貧血、Down綜合徵、Bloom綜合徵等白血病發病率均較高;⑤其他血液病:如慢性粒細胞白血病、MDS、骨髓增生性疾病如原發性血小板增多症、骨髓纖維化和真性紅細胞增多症、陣發性血紅蛋白尿、多發性骨髓瘤、淋巴瘤等血液病最終可能發展成急性白血病,特別是ANLL。診斷檢查
 |
| 老年人急性淋巴細胞白血病檢查 |
診斷:急淋的診斷主要依靠骨髓檢查,見大量原始淋巴細胞,至少在25%,但一般急淋的骨髓象其原始細胞比例遠超過25%。
實驗室檢查:
1.外周血象白細胞計數於發病時,約有60%病例是增高的,>10×10E9/L,其中超過50×10E9/L者占近1/4病例。白細胞計數愈高,則原始淋巴細胞的比例亦愈高;白細胞計數不高者,有的較少出現原始細胞或不出現原始細胞,即所謂的亞白血病性白血病及非白血病性白血病。若外周血白細胞計數>50×10E9/L(5萬/mm3)。往往有明顯的淋巴結、肝、脾腫大,並常為T細胞免疫表型者。紅細胞計數常見降低,多數病例(2/3病例)呈中等度貧血,血細胞比容<30%,屬正細胞、正色素性貧血。血小板計數降低,約有60%以上病例<50×10E9/L(5萬/mm3)。
2.骨髓檢查骨髓液穿刺除作瑞氏染色形態學檢查外,還可作免疫表型,組織化學及細胞遺傳學檢測。當骨髓細胞密度甚高,以及網狀纖維增生而致骨髓液抽取有困難時(出現“乾抽”現象),則必須作骨髓活檢。骨髓檢查呈現細胞增生增高,並見大量淋巴系白血病細胞,但髓系及紅系前體細胞的形態是正常的,但數量減少,巨核細胞常示增生不良。
3.細胞化學過氧化物酶陰性;糖原PAS反應陽性成塊或顆粒狀;非特異性酯酶陰性;中性粒細胞鹼性磷酸酶增加。
 細胞化學
細胞化學4.血液生化
(1)血尿酸測定由於白血病細胞的細胞轉換率高,因此出現代謝紊亂,表現血尿酸增高,但很少見痛風症狀,然而要注意是否會出現尿酸性腎病,即使在沒有過高的白血病細胞時,亦會有血尿酸的增高。更要注意的是當患者同時有嚴重脫水時,尿酸性腎病發生的可能更大,甚至可致嚴重腎功能減退。
(2)血乳酸脫氫酶是增高的,原因是白血病細胞的轉換增加。
5.腦脊液(CSF)檢查兒童急淋初發者約有3%病例有中樞神經系統的侵犯,除一般CSF常規檢查外,CSF離心沉澱濃縮找白血病細胞對診斷是有幫助的。需注意的是當外周血細胞很高,白血病細胞比例很高時,腰椎穿刺可能造成的出血,會導致外周血白血病細胞的“種入”,因此有主張腰椎穿刺遲緩幾天操作,待化療後外周血白細胞已明顯下降不易找到白血病細胞時再做腰穿比較妥善。有中樞神經系統(腦及脊髓膜)浸潤時,表現為CSF壓力增高,蛋白增多,糖降低,並可見白血病細胞。
其他輔助檢查:X線檢查:胸片示前縱隔腫塊者占5%~10%病例,胸腺腫大常伴有胸腔積液。這類病例常見於T細胞急淋者。
鑑別診斷
 |
| 老年人急性淋巴細胞白血病診斷 |
3.某些感染性疾病如傳染性單核細胞增多症、弓形體病、巨細胞病毒感染均可有發熱、淋巴結腫大及肝脾腫大,並外周血可見異形淋巴細胞,鑑別主要靠細胞形態學檢查。
4.此外急淋中的非白血病性白血病型亦要與再障急做鑑別,但骨髓檢查有助於此2類疾病的鑑別,生化方面再障病例的血尿酸及乳酸脫氫酶均是降低的,而在白血病時可以升高。
併發症
有出血,嚴重感染和呼吸衰竭等。治療方案
 |
| 老年人急性淋巴細胞白血病治療 |
(2)發熱處理:多數白血病患者於發病時或病程中有發熱。發熱的原因絕大多數是由於感染所致,因此對發熱病例體溫>38℃者需作仔細的病原菌檢測,如咽拭培養,血、尿、痰液培養,X線胸部檢查等。病程早期的發熱多數是細菌感染,外周血白細胞計數<1×10E9/L者,多見的是革蘭陰性桿菌感染。發熱病例採樣作病原菌檢測後即進行治療。常用的抗生素組合是頭孢菌素加氨基糖甙類,例如頭孢他啶(復達欣)加阿米卡星。當然抗生素的選擇應根據不同病期,不同感染部位,外周血白細胞高低等情況來估計可能的病原菌而選用不同的抗生素。對疑及有革蘭陽性球菌、金葡菌感染者宜加用萬古黴素,以後待藥敏試驗有結果後再予以調整。晚期病例的發熱可能是卡氏肺孢子蟲感染,常表現為肺孢子蟲肺炎,治療可用甲氧苄啶(磺胺增效劑;三甲氧苄氨嘧),20mg/(kg/d),加用磺胺甲噁唑(Sulfamethoxazele)100mg/(kg/d),口服或靜脈注射,療程為14天。亦可套用噴他脒(戊烷脒)4mg/(kg/d),肌注,療程10~14天,噴他脒(戊烷脒)對腎臟有毒性,亦有白細胞、血小板降低及低血糖等副反應,臨床應注意。晚期病例,特別是用過多種抗生素及長期反覆套用腎上腺皮質激素及化療藥物者,易並真菌感染,可用酮康唑0.1~0.2g口服,3次/d或用氟康唑200~400mg靜脈滴注,1次/d,或用兩性黴素B靜脈滴注,劑量由1mg/d開始,逐日增加至每日總量1mg/kg。有發熱感染嚴重者,在套用抗生素的同時可靜脈滴注大劑量人血丙種球蛋白,400mg/(kg/d),療程5天左右。對嚴重感染而外周血有顆粒細胞缺乏者,可皮下注射G-CSF或莫拉司亭(GM-CSF),300μg/d,療程7~10天。對未能找到感染病灶,多種病原菌檢查陰性,多種抗病原菌治療又不見效者,其發熱原因少數可能是由於白血病本身的代謝所致,可給予對症處理,如對乙醯氨基酚(必理通)0.5~1.0g,1~3次/d,或用吲哚美辛(消炎痛栓劑)25~50mg肛用。
(3)出血處理:出血的原因主要是血小板減少,因此補充血小板是治療出血的有效措施。連續單採血小板懸液,每隔天輸注250ml,亦可輸注非連續單採血小板懸液或新鮮全血。止血藥物卡巴克絡(安絡血)10mg口服,3次/d,酚磺乙胺(止血敏)1~2g靜脈滴注,1次/d。由於白血病患者的出血絕大多數並非由於纖維蛋白溶解所致,並且白血病患者易並發彌散性血管內凝血,因此除非有足夠的實驗依據證實是由於纖維蛋白溶解而致出血,否則不宜套用抗纖溶藥物。若並有DIC,肝素宜用小劑量12.5~25mg,1次/6h。
(4)高尿酸血症處理:血尿酸>420μmol/L(7mg/dl),口服別嘌醇每次0.1g,3~4次/d,待血尿酸下降後可減為1~2次/d,每次0.1g,同時給碳酸氫鈉口服,3次/d,每次1g以鹼化尿液,並補充適量液體,保持足量尿液,對化療前外周血白細胞明顯增高者,於化療的同時可套用別嘌醇預防高尿酸血症的出現。(5)維持營養:白血病系嚴重消耗性疾病,特別是化、放療的副作用引起患者消化道功能紊亂。應注意補充營養,維持水、電解質平衡,給患者高蛋白、高熱量、易消化食物,必要時經靜脈補充營養。
2.化學治療
ANLL病例化療的完全緩解率為60%~85%,但是緩解後的治療,何種最佳至今尚無定論。
ANLL病例的最佳治療選擇是經化療取得完全緩解後作骨髓移植。
(1)誘導緩解治療:
誘導緩解治療的目的是使病者取得完全緩解。ANLL病例在取得緩解過程中一般要經歷一個骨髓再生抑制期,當然在M3亞型APL病例套用維A酸(全反式維甲酸)作誘導分化治療則又作別論。目前一般均採用聯合治療方案,常用的聯合方案的組成有以下5種:
①柔紅黴素(DNR)與阿糖胞苷(Ara-C)的聯合方案(DA方案):
柔紅黴素(D)45mg/(m2·d),靜推,第1~3天
阿糖胞苷(A)100~200mg/d靜滴,第1~7天
此方案是以阿糖胞苷套用7天,柔紅黴素用3天故亦稱為“7加3”方案。這一聯合方案要療程及劑量上可根據骨髓情況,外周血白細胞高低等做一些變動,諸如改為“5加2”方案或是“10加3”方案,劑量上有將阿糖胞苷增加至200mg/(m2·d)(或100mg/m2健康搜尋,每2小時1次),但多數的報導療效均不及“7加3”的組合變動的方案不是療效較低就是增加了藥物的毒性反應。另一種聯合方案是在“7加3”的基礎上再加硫鳥嘌呤(6TG)但多數的臨床報導此三藥的聯合併不能提高緩解率。在“7加3”方案的基礎上再加依託泊苷(VP16),對緩解率亦無明顯影響。
②三尖杉鹼與阿糖胞苷的聯合(HA方案):
三尖杉鹼(H)2~4mg/d,靜滴,第1~7天。
阿糖胞苷(A)100~200mg/d,靜滴,第1~7天。
亦可健康搜尋在以上三尖杉鹼與阿糖胞苷聯合中加入長春新鹼(O)2mg靜注,第1天,以及潑尼松(強的松)(P)40mg/d,口服,第1~7天,組成的HOAP方案與HA方案相比緩解率相仿。亦有在HA方案基礎上加硫鳥嘌呤(6TG)組成HAT方案。亦有將三尖杉鹼的劑量增高到4~6mg/d用藥4天,與阿糖胞苷7天治療聯合,此方案是以三尖杉鹼代柔紅黴素,亦是“7加3”的治療,其療效與一般劑量的HA方案類似。
③三尖杉鹼、阿糖胞苷以及柔紅黴素、阿糖胞苷的序貫聯合方案,方案中均加入潑尼松(強的松)組成HAP-DAP方案。
HAP方案:三尖杉鹼(H)3~4mg/d,靜滴,第1~7天。
阿糖胞苷(A)100mg/d,靜滴,第1~7天。
潑尼松(強的松)(P)40mg/d健康搜尋,口服,第1~7天(8~14天休息)鶒。
DAP方案:柔紅黴素(D)20~40mg/d健康搜尋,靜推第15~17天。
阿糖胞苷(A)100mg/d,靜滴,第15~19天。
潑尼松(強的松)(P)40mg/d,口服,第15~19天。
(此方案治前如外周血白細胞>50×109加用羥基脲1g,3次/d,共用2天健康搜尋,作預處理治療)
此方案的目的是集國外DA方案及國內HA方案的優點,加強誘導緩解治療的強度,縮短首次治療的間歇期減少耐藥幾率,提高完全緩解率。此方案的完全緩解率為74%,僅用1個療程即達到完全緩解的有30%
④其他藥物及方案:一些原作為ANLL化療鶒的二線藥物,現已被作為一線藥物套用於首次誘導緩解治療,如將鬼臼黴素類藥物VP16~213,組合於DA方案中,即在DA方案中加入依託泊苷(VP16~213)100mg/d靜滴第1~5天。又如將米托蒽醌替代柔紅黴素與阿糖胞苷聯合,米托蒽醌劑量為12mg/(m2·d),靜滴,第1~3天[>60歲者劑量為10mg/(m2·d)]靜滴這些方案的療效均沒有新的突破。大劑量阿糖胞苷一般作為緩解後治療用或復發時套用少數報導用HD-阿糖胞苷(Ara-C)加柔紅黴素取得90%的CR率,無疑此方案的毒副反應亦大,不宜用於老年患者,對此方案的療效評估有待積累更多的臨床資料鉑類藥物(順鉑,碳鉑)近年來被套用於ANLL的治療單藥的療效一般,可與米托蒽醌及阿糖胞苷方案聯合或與其他方案聯合,鉑類藥物套用於治療白血病可能在今後會有更多的有效報導。
⑤擇優方案:
A.IA方案:伊達比星(去甲氧柔紅黴素)加阿糖胞苷(Ara-C)的聯合方案。本方案原為急非淋的二線方案。主要治療難治、復發白血病。目前認為如果病人有經濟條件可作為一線治療用藥使病人在最短時間內獲得緩解,延長生存期h。
伊達比星(去甲氧柔紅黴素)(I)10mg/m2,靜推,第1~3天。
阿糖胞苷(A)100mg/m2,2次/d火罐網,靜滴,第1~7天
B.用維A酸(全反式維甲酸)治療急性早幼粒細胞白血病(APL),可達90%左右健康搜尋的完全緩解率。劑量是45mg/(m2·d),但近期的研究結果低劑量25mg/(m2·d)亦能同樣奏效,一般用藥40天左右可取得緩解。急性早幼粒細胞白血病患者很容易發生彌散性血管內凝血(DIC),預後很差。維A酸(全反式維甲酸)治療白血病很少在治程中出現DIC,從而大大地降低了病死率,並且亦不會在用維A酸(維甲酸)誘導分化治療過程中出現外周血粒細胞缺乏故而較少並發感染。維A酸(維甲酸)的副反應有皮膚口唇乾燥、脫屑、口角皸裂(71.5%)、骨及關節疼痛(22.47%)、頭痛、頭暈(46.44%)、噁心嘔吐,食慾減退(41.2%)肝功能損害(12.35%)以及外周血白細胞增高。這些副反應鶒一般均較輕多始於治療後1周,作一般對症處理,可繼續用藥觀察,反應重的可減量或停藥服藥後外周血白細胞增高是一個需要關注的副反應。高白細胞現象的出現有些病例可出現一些併發症健康搜尋,如肺、心、腎等臟器功能衰竭,腎功能衰竭等,稱之為維甲酸相關綜合徵。這類綜合徵的發生率在歐美報導較多,可達1/4左右,然在中國很少見。維甲酸相關綜合徵的產生機理可能是毛細血管通透性增加,白細胞釋放蛋白酶增多毛細血管內血細胞淤滯等因素當維A酸(維甲酸)治療後出現高白細胞現象時可酌情加用化療,如羥基脲,或三尖杉鹼或阿糖胞苷,嚴重的白細胞增高並出現症狀者可用白細胞分離術除去過多的白細胞對治前已見白細胞增高的APL病人可維A酸(維甲酸)與化療藥物同用,以防高白細胞現象的出現。
緩解後單用維A酸(維甲酸)鞏固強化治療易復發,故宜與其他化療聯合治療或交替維持治療。
此外據報導臨床試用含砷中藥(或砷製劑)誘導細胞凋亡對M3型誘導完全緩解率可達65%~98%。套用劑量為每天10mg加入5%葡萄糖液中靜脈滴注,持續28~40天,大多數患者在1個月左右達CR。治療中少數患者有肝、腎功能損害,消化道症狀,皮疹以及手足麻木,皮膚色素沉著,顏面及下肢水腫和胸,腹水等這些副反應程度健康搜尋一般較輕為可逆性,在停藥後能恢復;
總之緩解後的治療火罐網在時間上宜早不宜遲應於誘導緩解後即開始作強化治療,在劑量上宜大不宜小因患者已取得緩解,骨髓內有較好的正常細胞克隆生長,較大劑量的化療副反應比誘導緩解時小在藥物種類上,宜以多種藥物組成幾組方案序貫套用,可使耐藥幾率降低。
(3)難治和復發的ANLL的治療:一般認為,難治性ANLL包括2個或2個以上誘導緩解治療不能達成CR的ANLL,ANLL復發可發為早期復發和晚期復發。早期復發指首次CR後1年內復發的病例,而1年以後復發的病例屬於晚期復發。難治性和復發的ANLL鶒的治療也分誘導緩解治療和緩解後治療2個部分。
①誘導緩解治療:難治性和復發ANLL的重新誘導緩解治療鶒目前主張大劑量強力聯合化療和骨髓移植(包括allo-BMT和ABMT)等手段。
A.大劑量強力化療:大劑量阿糖胞苷?(Ara-C)單一或與其他在首次誘導緩解治療中未套用過的藥物聯合治療仍是難治性和復發AML緩解治療的最常用方法。早期資料報導鶒大劑量阿糖胞苷(Ara-C)單一治療,即阿糖胞苷(Ara-C)3g/m2,2次/d連用6天,可使50%患者達CR。以後臨床研究以大劑量阿糖胞苷(Ara-C)為基礎的多種聯合化療方案,結果表明,對預後差的患者,套用大劑量阿糖胞苷(Ara-c)(3g/m2,2次/d,連用4天)+甲氨蝶呤(MTX)[12mg/(m2·d)用於第3~5天或更長時間]CR率可達53%
B.骨髓移植:在首次復發的ANLL患者實施allo-BMT效果較好而在第2次緩解後進行則療效較差健康搜尋ABMT能使40%左右的難治性和復發ANLL患者,包括一些對大劑量阿糖胞苷(Ara-C)耐藥的病例達CR,但緩解期短,復發率高
②緩解後治療:第2次緩解期通常為數月,但目前已有10%~20%患者具有較長二次緩解期。有資料表明,緩解後套用小劑量阿糖胞苷(Ara-C)10mg/m22次/d,皮下注射,與對照組比較,本方案可使更多病例的2次緩解期比首次緩解期長。
(4)造血因子在ANLL中的套用:①集落刺激因子:非格司亭(粒細胞集落刺激因子;G-CSF)、莫拉司亭(粒-巨噬細胞集落刺激因子;GM-CSF)套用後可使粒系細胞提早恢復,有利於減少或控制感染但是這類CSF亦可刺激粒(或單核)系白血病細胞的增殖,因此對粒(或單核)系白血病,套用非格司亭(G-CSF)或莫拉司亭(GM-CSF)。後白血病細胞的變化,有正負兩方面的作用,正的作用是白血病細胞受CSF刺激後進入細胞增殖周期,有利於化療藥物殺滅白血病細胞火罐網負的作用是當白血病細胞增殖後,若對化療藥物不敏感則將是不利健康搜尋的。因此在無法了解藥物敏感性時火罐網對粒(單核)系白血病,只宜在化療後骨髓明顯受抑制已不易找到白血病細胞而呈粒細胞缺乏時,才套用非格司亭(G-CSF)或莫拉司亭(GM-CSF)。通常集落刺激因子是在化療結束24~48h後套用,劑量為150~200µg/(m2·d)直至白細胞恢復正常。
②其他造血生長因子:如IL-3.IL-6和促血小板生成素(TPO)等都已進行臨床Ⅲ期試驗,已經表明IL-3.IL-6和TPO均能升血小板,從而減少血小板輸注和化療中與出血相關的死亡率。尤其TPO具有更大的臨床套用價值。IL-3尚有促進粒細胞增殖作用火罐網,但其效果不及莫拉司亭(GM-CSF)或非格司亭(G-CSF)健康搜尋。
(5)ANLL中幾種特殊情況的治療:①骨髓低增生型ANLL:這類病例是指骨髓內造血細胞成分比例的減少,只占5%~40%,多見於50歲以上老年人往往是由骨髓增生異常綜合徵或再障演變而來。骨髓細胞分類中往往原始細胞的比例不很高(40%以下),外周血白細胞計數不高,或偏低。這類病例的化學治療的效果很差,因此有作者主張以支持療法為主,以延長其生存期。
②髓外白血病的治療:中樞神經系統白血病的治療,前已述及。綠色瘤又稱髓母細胞瘤或粒細胞肉瘤,見於急性粒細胞白血病患者,多見於骨膜周圍及神經周圍區域,好發於面部骨骼及脊髓,面部眼眶後骨膜綠色瘤將眼球向外推出,脊髓綠色瘤常致浸潤部位橫斷面以下的脊髓神經功能受損,多見的症狀是下肢截癱,大小便滯留。有局部髓外白血病浸潤的治療在全身治療的基礎上局部加放射治療。
3.免疫治療 目前已用於ANLL患者體內微小殘留病灶(MRD)的免疫治療手段有:①同種淋巴細胞輸注。②阿地白介素(白細胞介素-2;IL-2)。③單克隆抗體。④Linomide。
4.多藥耐受(MDR)逆轉的治療 大部分復發和難治性AML與MDR有關MDR的機制與P-gp健康搜尋的藥泵功能有關,抑制P-gp藥泵功能藥物的開發已是目前的一大熱門課題至今已嘗試於臨床的這類藥物有環孢素、奎寧他莫西芬(tamoxifen)、dexcerapamildexniguidipine、PSC833和GF120198等。在已完成臨床Ⅰ/Ⅱ期試驗的藥物中,僅環孢素(CsA)能達到具有逆轉MDR患者的P-gp藥泵功能以恢復穩定藥物的血漿濃度。並明顯延長柔紅黴素(DNR)和甲氨蝶呤(MTX)的清除。
5.骨髓移植 有條件者應於取得第1次完全緩解後進行異基因骨髓移植(allo-BMT)可取得45%~60%的無病生存率健康搜尋其療效與年齡成反比,>45歲的患者大部分療效差。而自身骨髓移植(ABMT)適用範圍比前者廣,可用於<60歲的AML患者。一些研究結果表明ABMT的療效與allo-BMT的相似,而前者與治療相關的病死率僅3%~5%,遠低於allo-BMT治療相關病死率25%~40%
6.靶基因治療目前已認識到AML的發病與許多癌基因以及某些AML的特異的融合基因有關,對這些基因及基因編碼蛋白鶒的阻斷將從根本上治療AML。從某種角度上分析,維A酸(ATRA)治療APL是一個典型的基因靶治療,維A酸(ATRA)可以使致APL的融合蛋白PML/RARa快速降解。其次,反寡核苷酸將在基因水平治療AML,已有報導在復發的AML患者中,輸注P53的反義寡核苷酸可使該靶基因表達下調。可以構想,隨著對AML發病機制的深入認識,和更多特異的致AML基因的發現,今後AML的基因靶治療將是一個重要的手段。
預後及預防
 |
| 老年人急性淋巴細胞白血病預防 |
預防:提高機體免疫力,預防感染為主。
流行病學
 |
| 老年人及嬰幼兒健康 |
1.地區分布白血病是世界範圍較多見的惡性腫瘤,屬於我國十大高發惡性腫瘤之一。我國白血病年發病率為2.73/10萬人口,標化率為2.62/10萬人口,與日本相似(2.4/10萬~2.7/10萬人口),明顯低於歐美6.4/10萬~10.5/10萬人口。歐美國家的亞裔移民白血病發病率也明顯低於白種人。我國各地區白血病發病率基本接近全國平均水平,少數地區白血病發病率與全國水平不一致。如河北開灤煤礦、湖北江漢油田的白血病發病率各達6.11/10萬人口及7.40/10萬人口,提示環境污染可能與白血病的發病相關。
2.性別、年齡分布各國男性白血病的發病均高於女性。男、女之比為1~1.6∶1。1986年我國男性發病率為2.82/10萬人口、女性為2.45/10萬人口,在老年期男性發病率明顯高於女性。白血病見於各年齡組,自嬰幼兒至高齡老年。我國防大學1986年普查0~9歲及60~69歲年齡階段存在不同程度的發病高峰。ALL多見於兒童,<10歲組中,ALL占70%,其次為AML,<20歲組以AML較多見,ALL略次之,20~40歲組以AML居首,CML次之,>40歲以AML或CML為多見。
3.白血病的類型分布我國白血病的類型隨年代進展而有所變化,表現為急性病例增多。北京協和醫院1921~1942年慢性與急性白血病之比為2.38∶1;1949~1955年為0.7∶1;1956~1958年則為0.33∶1。1986年普查資料,1498例白血病中ANIL占57%,all27%,CML14%,CLL僅占2%,慢性白血病與急性之比為0.24∶1,與非洲國家相似。西方國家慢性白血病發病率較高,尤其是CLL明顯多於亞洲國家。