定義
 理想氣體狀態方程演示儀
理想氣體狀態方程演示儀處於平衡態的氣體,可用體積V、壓強P、溫度T三個巨觀狀態參量來描述,在溫度不太低、壓力不太大的範圍內,遵守玻意耳-馬略特定律,蓋呂薩克定律和查理定律。滿足上述氣體實驗三定律的氣體稱為理想氣體。理想氣體是一個理想模型,實際氣體在P→0時(密度足夠低)的極限情況下可視為理想氣體。在平衡態下,一定量氣體的狀態參量P、V、T之間的關係式稱為氣體的狀態方程。理想氣體在平衡態下狀態參量P、V、T之間的關係式稱為理想氣體狀態方程。
解釋
平衡態
平衡態的英文是equilibriumstate。在不受外界影響的條件下,系統的巨觀性質不隨時間改變的狀態,稱為平衡態。處於平衡態的氣體分子仍在做熱運動,但系統的巨觀量不隨時間改變,是一種動態平衡。
系統
由大量分子組成的物體叫作熱力學系統,簡稱系統,系統以外的物體統稱外界。
巨觀量
描述體系整體性質的物理量。例如壓強、溫度、體積。
微觀量
描寫體系中每個粒子微觀運動狀態的物理量,例如質量、位置、速度。
公式
 圖示一
圖示一公式如圖示。
其中M為氣體的質量,μ為氣體的摩爾質量,R=8.31J/(mol·K)為氣體的普適常數。上式可作為理想氣體的定義式。該式還可表示如圖示二。
 圖示二
圖示二其中n—分子數密度,即單位體積的分子數,k=(R/NA)=1.38×10-23J/K—玻耳茲曼常數(Boltzmanconstant)。
經驗規律
理想氣體狀態方程是描述氣體巨觀運動的經驗規律。
推導
 理想氣體狀態方程
理想氣體狀態方程(1)玻意耳定律(玻—馬定律)
當n,T一定時V,p成反比,即V∝(1/p)①
(2)查理定律
當n,V一定時p,T成正比,即p∝T②
(3)蓋-呂薩克定律
當n,p一定時V,T成正比,即V∝T③
(4)阿伏伽德羅定律
當T,p一定時V,n成正比,即V∝n④
由①②③④得
V∝(nT/p)⑤
將⑤加上比例係數R得
V=(nRT)/p即PV=nRT
實際氣體中的問題當理想氣體狀態方程運用於實際氣體時會有所偏差,因為理想氣體的基本假設在實際氣體中並不成立。如實驗測定1mol乙炔在20℃、101kPa時,體積為24.1dm,,而同樣在20℃時,在842kPa下,體積為0.114dm,,它們相差很多,這是因為,它不是理想氣體所致。
一般來說,沸點低的氣體在較高的溫度和較低的壓力時,更接近理想氣體,如氧氣的沸點為-183℃、氫氣沸點為-253℃,它們在常溫常壓下摩爾體積與理想值僅相差0.1%左右,而二氧化硫的沸點為-10℃,在常溫常壓下摩爾體積與理想值的相差達到了2.4%。
套用一定量處於平衡態的氣體,其狀態由p、V和T刻劃,表達這幾個量之間的關係的方程稱之為氣體的狀態方程,不同的氣體有不同的狀態方程。但真實氣體的方程通常十分複雜,而理想氣體的狀態方程具有非常簡單的形式。
雖然完全理想的氣體並不可能存在,但許多實際氣體,特別是那些不容易液化、凝華的氣體(如氦、氫氣、氧氣、氮氣等,由於氦氣不但體積小、互相之間作用力小、也是所有氣體中最難液化的,因此它是所有氣體中最接近理想氣體的氣體。)在常溫常壓下的性質已經十分接近於理想氣體。
此外,有時只需要粗略估算一些數據,使用這個方程會使計算變得方便很多。
正文
狀態方程
描寫理想氣體狀態變化規律的方程。對於一定質量的氣體,可以用壓強p和體積V來描述它的平衡態,而溫度T是p和V的函式,F(T,p,V)=0。這個關係式叫做氣體的狀態方程,它的具體形式需由實驗確定。玻意耳定律
又稱玻意耳—馬略特定律,是英國化學家R.玻意耳在1662年和法國物理學家E.馬略特在1679年分別獨立發現的。它的內容是:一定質量的氣體,當溫度保持不變時,壓強和體積成反比且乘積是一個常數:
p1V1=p2V2=p3V3=…或pV=C。
常數C 在不同溫度時有不同數值。
大量實驗結果表明,該定律對理想氣體完全正確。對於各種實際氣體,只要它的壓強不太高,溫度不太低,都近似地遵從此定律;氣體的壓強越低,它遵從玻意耳定律的精確度就越高。
蓋-呂薩克定律
一定質量的氣體,當體積不變時,它的壓強隨溫度作線性變化:
p=p0(1+αt),p0
是0°C時的氣體壓強,p是t°C時的氣體壓強,α是在氣體體積不變時的壓強係數。對於理想氣體,α的數值為一普適常數,其值為1/273.15,於是: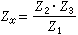
pt=p0αT,T
即為熱力學溫標,其單位是開爾文 (K);t=0時,T0=273.15K。
理想氣體狀態方程
根據玻意耳定律、阿伏伽德羅定律和理想氣體溫標的定義,可以確定玻意耳定律中常數C與溫度的關係,並可導出:
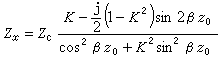
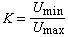 的數值對各種氣都一樣。該數值叫摩爾氣體常數並用r表示:
的數值對各種氣都一樣。該數值叫摩爾氣體常數並用r表示: 
於是 式中M代表氣體的質量,μ 是氣體的分子量。這就是理想氣體狀態方程。
式中M代表氣體的質量,μ 是氣體的分子量。這就是理想氣體狀態方程。
在壓強為幾個大氣壓以下時,各種實際氣體一般都近似地遵從理想氣體狀態方程。壓強越低,符合的程度越高。在壓強趨於零的極限情況下,一切氣體都嚴格地遵從它。根據理想氣體模型從氣體分子運動論出發,也可以推導出該物態方程。
摩爾氣體常數R R的數值可由一摩爾理想氣體在水的三相點 (273.16K)及一個大氣壓下的體積推出。也可以由一摩爾理想氣體在冰點 (273.15K)及一個大氣壓下的體積V0推出。用V0來推算的原因是 V0可根據實驗結果求得比較準確的數值。由
V0=22.41383×10-3 m3 /mol
可算得r=8.31441±0.00026J/(mol·K)。
套用
計算氣體所含物質的量
 理想氣體狀態方程
理想氣體狀態方程求壓強:p=nRT/v
求體積:v=nRT/p
求所含物質的量:n=pv/RT
求溫度:T=pv/nR
計算化學平衡問題
根據理想氣體狀態方程可以用於計算氣體反應的化學平衡問題。
根據理想氣體狀態方程可以得到如下推論:
溫度、體積恆定時,氣體壓強之比與所含物質的量的比相同,即可得Ρ平/P始=n平/n始
溫度、壓強恆定時,氣體體積比與氣體所含物質的量的比相同,即V平/V始=n平/n始
通過結合化學反應的方程,很容易得到化學反應達到平衡狀態後制定物質的轉化率。
實際氣體
實際氣體都不同程度地偏離理想氣體定律。偏離大小取決於壓力、溫度與氣體的性質,特別是取決於氣體液化的難易程度。對於處在室溫及1大氣壓左右的氣體,這種偏離是很小的,最多不過百分之幾。如氧氣和氫氣是沸點很低的氣體(-183攝氏度和-253攝氏度),在25攝氏度和1大氣壓時,摩爾體積與理想值的偏差在0.1%以內。而沸點較高的二氧化硫和氯氣(-10攝氏度與-35攝氏度),在25攝氏度與1大氣壓下就不很理想。它們的摩爾體積比按理想氣體定律預計的數值分別低了24%與16%。當溫度較低、壓力較高時,各種氣體的行為都將不同程度地偏離理想氣體的行為。此時需要考慮分子間的引力和分子本身的體積重新構造氣體狀態方程。
化學平衡
根據理想氣體狀態方程可以用於計算氣體反應的化學平衡問題。
根據理想氣體狀態方程可以得到如圖示三推論。
通過結合化學反應的方程式,很容易得到化學反應達到平衡狀態後制定物質的轉化率。
注釋
p為理想氣體的壓強,單位通常為atm或kPa;
V為理想氣體的體積,單位為L或稱dm3;
n為理想氣體中氣體物質的量,單位為mol;
R為理想氣體常數、普適氣體恆量,更多值參見理想氣體常數;R=NK(N為阿伏伽德羅常數,Avgadro'snumber;K為玻爾茲曼常數,Boltzmannumber)
T為理想氣體的絕對溫度,單位為K
^在所有氣體當中,氦氣是構成粒子中最小的,氫氣僅次之。
^氦還是唯一不能在標準大氣壓下固化的物質。
^約合739mm
^atm為標準大氣壓,1atm=101.3kPa
^當時查理認為是膨脹1/267,1847年法國化學家雷諾將其修正為1/273.15。
^其實查理早就發現壓力與溫度的關係,只是當時未發表,也未被人注意。直到蓋-呂薩克重新提出後,才受到重視。早年都稱“查理定律”,但為表彰蓋-呂薩克的貢獻而稱為“查理-蓋呂薩克定律”。
^如二氧化碳在40℃、52MPa時,Z≈1.0
物理學定律(1)
| 陳述各物理學定律的相關知識點。1.完成有效版本前三名分別獎勵350、200、100百科幣。(任務結束後當周發放);2.內容應符合專業、客觀、中立,具有較強的知識性和專業性,用詞規範、排版美觀、闡釋適度、通俗易懂,符合網際網路閱讀習慣,達到百科詞條的典範之作。請參考:互動百科:詞條標準。3.評審團由物理學專家、科學編輯莫小夏、浪花N朵朵組成。有任何意見、建議可在任務討論區提出。 |

