簡介
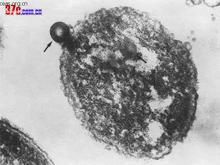
多形擬桿菌的二個環層體,一個分泌出細胞外(↑),另一個仍留在細胞內(↑↑)超薄切片,×112000。
 .
.多形擬桿菌是人類腸道中數量最大的細菌之一,能夠根據食物來源的變化,將自身四分之一以上的基因調節到活躍狀態,分解人體本身無法消化的多糖如纖維素等,在向宿主提供營養的同時也為自己和腸道中的其他細菌獲得食物。
詳細說明
菌種低溫保存法
①簡單保存法,將瓊脂斜面孢子培養物、菌絲懸浮液以及由麩皮、大米、小米等穀物原料製成的孢子培養物置於4℃冰櫃保存,保存時間不超過1~2個月,若將穀物原料製備的孢子瓶抽真空並在棉塞上浸蠟,以隔絕外界空氣和水汽,保持時間可達3~4個月;
②液氮超低溫保存法,將生長穩定期的細胞懸浮在10%甘油或其他低冰點液體中,密封於安瓿管內,然後控制冷卻速度,使安瓿管溫度逐步下降至-35℃時,即可置於-150~-196℃的液氮罐中保存。大多數微生物如病毒、噬菌體、多種細菌、放線菌、酵母和原蟲、特別是一些用冷凍乾燥法有困難的微生物,都可用此法長期保存。
脫水保存法
①沙土保存法,能產孢子的細菌、放線菌及黴菌可採用此法保存,即將沙和土以3:2比例混合,經稀酸處理洗淨過篩,裝入小試管內,裝置高度為1cm;滅菌2~3次,烘乾後即可將在斜面培養基上生長良好的孢子,用無菌蒸餾水2~2.5ml製成孢子懸液,吸取少許加入沙土管中,經真空抽乾,外觀呈鬆散狀態,於4℃冰櫃保存,保存期可達5~7年。
②冷凍乾燥法,將孢子懸浮液與保護劑(一般用脫脂牛奶或血清)相混合,放在安瓿管內於-20~-30℃的乙醇浴中速凍。然後,在低溫下用真空泵抽乾,並用五氧化二磷或乾冰使水汽結凍,熔封安瓿管,於低溫下保存。保存期可達5~10年之久。
③石蠟油封存法,在斜面菌種培養物上,倒上滅菌後的石蠟油,高出斜面1cm,於4℃冰櫃或低溫乾燥處保存,此法不適用於能利用石蠟油作碳源的微生物,保存期為一年以上。
人體內多形擬桿菌的新認識
腸道中的一種常見細菌――多形擬桿菌,能夠根據食物來源的變化,將自身四分之一以上的基因調節到活躍狀態。這一發現讓科學家對腸道菌群有了新的認識。
多形擬桿菌是人類腸道中數量最大的細菌之一,它能夠分解人體本身無法消化的多糖如纖維素等,在向宿主提供營養的同時也為自己和腸道中的其他細菌獲得食物。
美國華盛頓大學聖路易斯分校研究人員在最新一期《科學》雜誌上報告說,當宿主的食譜變化時,多形擬桿菌能迅速調節自己的基因組,更好地消化新食物,這樣維持了整個腸道菌群的健康。
華盛頓大學聖路易斯分校教授傑弗里?戈登等人在實驗中向無菌實驗鼠注射多形擬桿菌,再分別用高多糖、低單糖的飼料和單糖飼料餵養實驗鼠,10天后,觀察實驗鼠腸道內的多形擬桿菌。結果發現,多形擬桿菌基因組4779個基因中,吃高多糖、低單糖飼料的實驗鼠體內的多形擬桿菌有1237個基因被調節到了相對活躍的狀態;而吃單糖飼料的實驗鼠,其體內的多形擬桿菌則啟用了一套不同的基因,幫助實驗鼠吸收利用單糖。
戈登說,多形擬桿菌的複雜程度超出人們早先的認識。它在消化多糖時,能夠在外表生成一些蛋白質,附著在富含多糖的食物微粒上,此外它還能生成一些細胞器幫助消化多糖。而吃單糖飼料的實驗鼠腸道內的細菌,就沒有這些蛋白質。多糖是由很多分子單糖結合而成的高分子碳水化合物,必須先經消化分解為單糖。單糖是最簡單的碳水化合物,可以不經消化直接為機體所吸收利用,腸道內的多形擬桿菌不需要合成特殊的蛋白質,編碼這些蛋白質的基因也就沒有必要激活了。因此,研究人員認為,多形擬桿菌所調節的基因,是控制消化多糖的蛋白質的。
這一發現對人類健康有重要意義。戈登說,人類腸道中生活著上百萬億個細菌,構成了微型生態環境,它們能分解人類自身不能消化的食物,可以說是人類的“微生物器官”。腸道細菌生態的變化,可能是影響肥胖以及肥胖引起的糖尿病、心臟病的重要因素。下一步,科學家將研究多形擬桿菌基因調節功能與人類肥胖症之間的聯繫。
宿主發生相互作用
通過對小鼠進行實驗,研究人員發現,多形擬桿菌可與宿主發生相互作用,向宿主提供營養物質。研究人員先將小鼠飼養於一種完全無菌的環境中(保證它們不攜帶任何細菌),然後再讓小鼠與多形擬桿菌接觸。2005年,美國華盛頓大學聖路易斯分校的研究人員發現,多形擬桿菌通過食用多糖分子,即結構複雜的碳水化合物而存活。多形擬桿菌會讓這些營養物質發酵,生成短鏈脂肪酸(也就是它們的排泄物),為小鼠提供養分。通過這種方式,細菌從那些本來無法消化的碳水化合物中得到了熱量,比如燕麥片中的膳食纖維。研究人員還發現,如果要獲得相同的體重,那些沒有攜帶多形擬桿菌的小鼠,需要比攜帶了這種細菌的小鼠多吃30%的食物。
對共生細菌的研究還使一種病原菌——幽門螺鏇桿菌(Helicobacterpylori)重獲好名聲。20世紀80年代,澳大利亞醫師巴里·馬歇爾(BarryMarshall)和羅賓·瓦倫(RobinWarren)發現,幽門螺鏇桿菌(可以在胃內酸性環境中旺盛生存的少數病菌之一)是引發胃潰瘍的病原菌。在這之前人們一直認為,持續使用非類固醇消炎藥(NSAID,阿司匹林就是這類藥物)是導致胃潰瘍的常見病因,所以細菌引發胃潰瘍的新發現,很快就成了當時引人注目的新聞。從那以後,套用抗生素治療胃潰瘍就成了一種標準的臨床治療方法。很快,由幽門螺鏇桿菌引發的潰瘍發病率就下降了50%多。
但是,紐約大學的內科和微生物學教授馬丁·布雷澤(MartinBlaser)認為,事情遠不是這樣簡單。布雷澤教授研究幽門螺鏇桿菌已經25年了。“與別人一樣,剛開始我也認為幽門螺鏇桿菌只是一種病原體,但幾年之後,我認識到,它實際上是一種與人體共生的有益細菌。”1998年,布雷澤和同事發現,幽門螺鏇桿菌對絕大多數人都是有益的,它可以調節胃酸水平,創造既適合它生存也適合宿主(人體)的環境。比如,當胃酸分泌過多時,幽門螺鏇桿菌會大量繁殖,同時細菌內的cagA基因開始產生一種蛋白質,使胃部減少胃酸的分泌。不過,對於易感人群來說,cagA有一種不好的副作用,會加重幽門螺鏇桿菌引起的潰瘍。