簡介
 同離子效應
同離子效應種類
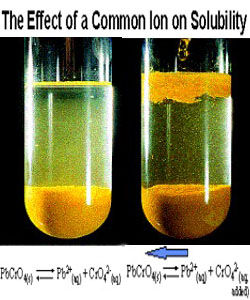
同離子效應有兩種,一種是降低弱電解質的電離度;另一種是降低原電解質的溶解度。即,在電解質1的飽和溶液中,加入和電解質1有相同離子的強電解質2,因而降低電解質1的溶解度的效應叫同離子效應。這種效應對於微溶電解質特別顯著,在化學分析中套用很廣。對此現象可以這樣來理解:難溶電解質的溶解和沉澱是一種動態平衡,所以溶液中有關離子濃度的(某種!)乘積是一個常數--溶度積。例如[BiO+][Cl-]=Ksp=常數c,假定原來單純的BiOCl的飽和溶液中,[BiO+]=[Cl-];加了NaCl後,[Cl-]大大增加,常數c不變,因為[BiO+]=Ksp/[Cl-],所以[BiO+]大大降低,它無處可去,只有沉澱![BiO+]降低就意味著BiOCl的溶解度下降了。從溶解平衡角度來解釋,BiO++Cl-=BiOCl↓當Cl-增加時,平衡被打破,反應向右進行。
上面提到的降低弱電解質的電離度的原理類推。
在弱電解質溶液中加入含有與該弱電解質具有相同離子的強電解質,從而使弱電解質的解離平衡朝著生成弱電解質分子的方向移動,弱電解質的解離度降低的效應稱為同離子效應。
①使弱電解質電離度減小例如,在醋酸溶液中加入醋酸鈉,由於醋酸鈉是強電解質、在水中全部電離成Na+和Ac-,溶液中Ac-濃度增大,大量的Ac-同H+結合成醋酸分子,使醋酸的電離平衡向左移動
因此,醋酸的電離度減小,溶液中H+濃度降低。在弱鹼溶液中加入弱鹼鹽,例如,在氨水中加入氯化銨,也存在同離子效應。有同離子效應時計算氫離子濃度的一般公式為:
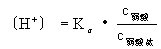 式中Kα為弱酸的電離常數,c為濃度。同理可得:
式中Kα為弱酸的電離常數,c為濃度。同理可得: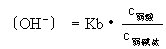 式中Kb為弱鹼的電離常數。
式中Kb為弱鹼的電離常數。②使難溶鹽溶解度降低例如,硫酸鋇飽和溶液中,存在如下平衡:
在上述飽和溶液中加入氯化鋇,由於氯化鋇完全電離,溶液中[Ba2+]突然增大,[Ba2+]>KSP,原來的平衡遭到破壞,>KSP時,[Ba2+]大於BaSO4溶解在純水中的鋇離子濃度,而平衡向左移動,析出BaSO4沉澱。當溶液中再次建立新的平衡,即[Ba2+]則小於BaSO4溶解在純水中的硫酸根濃度,硫酸鋇的溶解度可用新的平衡狀態下的來量度。因此BaSO4在BaCl2溶液中的溶解度比在純水中要小。即加入含相同離子的強電解質BaCl2使難溶鹽BaSO4的溶解度降低。同離子效應也可以降低易溶電解質的溶解度。例如,在飽和的NaCl溶液中加入濃鹽酸或通入氯化氫氣體,也可以使NaCl晶體析出。
實驗
同離子效應使難溶電解質的溶解度降低原理
在已經建立起溶解平衡的難溶電解質的溶液中,加入含有相同離子的另一強電解質溶液時,由於離子濃度的增加,會使平衡向著生成沉澱的方向進行移動,從而達到新的溶解平衡。可見相同離子效應會也使難容電解質的溶解度降低。[用品]試管、飽和硝酸銀溶液、飽和醋酸銀溶液、飽和醋酸鈉溶液、飽和硝酸鉀溶液、飽和氯化鉛溶液、飽和氯化鈉溶液、飽和硫酸鋇溶液、硫酸。
操作
1、硫酸對硫酸鋇飽和溶液的作用。取二支盛有硫酸鋇飽和溶液的試管,在其中一試管中加入硫酸鋇的飽和溶液,另一試管中加入硫酸,可以看到,只有在加入硫酸的試管中才有渾濁現象產生。
這是由於BaSO4(s)=Ba2+(aq)+SO42-(aq)
[Ba2+][SO42-]=KSP=1.8×10-10
在上述飽和溶液中加入相同離子SO42-,使離子濃度增大,平衡向著生成沉澱的方向即降低硫酸鋇溶解度方向移動。
2.銀離子對醋酸銀溶解度的影響和醋酸根離子對醋酸銀溶解度的影響。
取兩支盛有醋酸銀飽和溶液的試管,其中一支加入飽和的硝酸銀溶液,一支加入飽和的醋酸鈉溶液,邊加邊振盪試管,會發現兩試管中都有白色沉澱析出。即銀離子、醋酸根離子都與醋酸銀有共同離子。其作用的結果是,在增大共同離子的濃度後,會使溶解平衡向著不溶的方向進行移動。
3.氯離子對氯化鉛溶解度的影響。
在一支試管中加入飽和氯化鉛溶液,用滴瓶滴入飽和氯化鈉溶液,邊滴邊搖動,直到觀察到有白色沉澱析出為止。