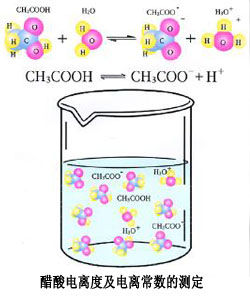
定義和計算
 電離度
電離度=(分子、分母同除以溶液體積)
【例1】25℃時,在0.1mol/L醋酸溶液里,每10000個醋酸分子裡有136個分子電離成離子。它的電離度是多少?
解:α=136/10000=1.36%
答:它的電離度是1.36%。
【例2】在氟化氫溶液中,已電離的氟化氫為0.2mol,未電離的氟化氫為1.8mol。求該溶
 電離度
電離度解:α=0.2/(0.2+1.8)=0.2/2=10%
答:該溶液中氟化氫的電離度為10%。
對於一元弱酸,當c∕Ka≥500時,可以推導出一元弱酸電離度與氫離子濃度的近似公式:
[H+]=√c·Ka
α=[H+]∕c=√c·Ka∕c=√Ka∕c
對於一元弱鹼,當c∕Kь≥500時,可以推導出一元弱鹼電離度與氫氧根離子濃度的近似公式:
[OHˉ]=√c·Kь
α=[OHˉ]=√c·Kь∕c=√Kь∕c
由上述公式可以看出:
當溫度與濃度一定時,對於不同的弱電解質,Ka或Kь越大,則α越大,溶液酸性(對於一元弱酸)或鹼性(對於一元弱鹼)越強。
當溫度一定時,對於同一弱電解質來說,濃度越小,則α越大,但溶液酸性(對於一元弱酸)或鹼性(對於一元弱鹼)越弱。
因此,在表示弱電解質的電離度時,必須指明溶液的濃度和溫度。
氣體電離度可用如下公式表示:α=n/N
n:帶電離子數目;
N:氣體質點總數目。
影響因素
引起電離的原因很多。例如,氣體粒子受電子或離子的撞擊或受電磁波(光、X射線等)的輻照,固體表面受電子或離子轟擊,固體受到高熱等,都有可能產生電離現象。內因:電解質的本性。
外因:溫度和溶液的濃度等。
濃度的影響
醋酸稀釋時電離度變化的數據:| 濃度(mol/L) | 0.2 | 0.1 | 0.001 |
| 電離度(%) | 0.948 | 1.32 | 12.4 |
溫度的影響
因為電離過程是吸熱的,因此溫度升高離子化傾向加強,又因大多數電解質電離時沒有顯著的熱量變化,這就導致溫度對電離度雖有影響,但影響並不大的必然結果。一般情況下,溫度對電離度影響不大,但水的離解過程顯著吸熱,所以溫度升高可以增大水的電離度。因此,用電離度比較幾種電解質的相對強弱時,就當注意所給條件,即濃度和溫度,如不註明溫度通常指25℃。
在相同溫度和濃度時,電離度的大小可以表示弱電解質的相對強弱。
【例3】下列關於電離度α的敘述正確的是(D)
①α與濃度無關;②α值隨溫度升高而增大;③在相同條件下,α值的大小可以表示弱電解質的相對強弱;④α值增大,相應離子濃度一定增大;⑤α值增大相應離子物質的量增大。
A.①②③B.①②④C.③④⑤D.②③
電離常數又叫電離平衡常數,用Ki表示。如醋酸,碳酸和硼酸。其定義為,當弱電解質電離達到平衡時,電離的離子濃度的乘積與未電離的分子濃度的比值叫做該弱電解質的電離平衡常數。一種弱電解質的電離平衡常數隻與溫度有關,而與該弱電解質的濃度無關。因為弱電解質通常為弱酸或弱鹼,所以在化學上,可以用Ka、Kb分別表示弱酸和弱鹼的電離平衡常數。
用HA表示弱酸,則其電離方程式為HA——H+A,則電離常數Ka=[H]*[A]/HA
電離常數K與電離度α的關係可近似的表示為K=cα2(α平方)其中c為弱電解質溶液的濃度。