亦稱效應劑,是指凡能觸發蛋白質或酶分子發生變構效應的物質。與酶分子結合的部位往往是酶的非催化部位,即活性中心外別的部位,即別位或調節部位。
別構效應
別構效應亦稱變構效應,是指一個蛋白質與它的配體結合後,蛋白質的構象發生變化,使它更適合於功能的需要,這一類變化稱為別構效應。
別(變)構蛋白質(酶)
是指具有別構效應的蛋白質或酶。
別構效應的意義
別構效應的意義-----主要是構成代謝的負反饋調節
即當一個代謝途徑的代謝產物增多時,反饋抑制關鍵酶,使代謝速度減慢,避免代謝產物的大量堆積。
血紅蛋白的別構效應
Hb與O2結合前,Hb的構象處於緊張態,不利於與O2的結合Hb的4個亞基通過鹽鍵、疏水鍵聚合在一起,在2個β-亞基之間夾著1分子2,3-二磷酸甘油酸(2,3-DPG),2,3-DPG的3個負電基團與β-亞基的3個正電基團形成鹽鍵,此時Hb的構象處於緊張態(tensestate,T態),各亞基對O2的親和力比較低,不易與O2結合。
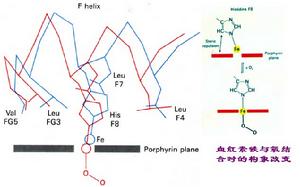
此時鐵原子5個配位鍵中的4個分別與血紅素卟啉環上N原子相連線,1個與F8位組氨酸的N原子相連,鐵原子仍具有不成對電子,故此時鐵原子的直徑較大(比卟啉環當中的孔大),突出卟啉平面約為0.075nm。
Hb與O2結合後,Hb的構象處於松馳態,有利於與O2的結合O2與鐵原子以配位鍵結合後,鐵的配位數由5變為6,鐵原子直徑減少(因沒有不成對電子),能移動0.075nm進到卟啉環當中的孔穴中,這一移動通過F8位組氨酸牽動了它所在的肽段,進而影響Hb亞基間的相互作用,破壞了鹽鍵和其它次級鍵,擠出了β-亞基間的2,3-DPG,使亞基間的聚合變得疏鬆,整個分子處於鬆弛態(relaxedstate,R態),有利於與O2的結合。
血紅素鐵與氧結合時構象改變圖
 別構劑
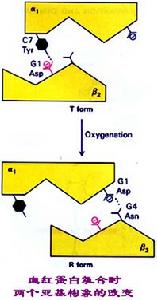
別構劑血紅蛋白氧合時α1β2構象改變圖
 別構劑
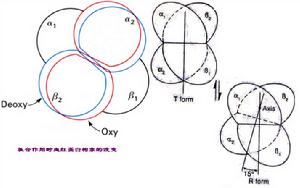
別構劑血紅蛋白氧合時四級結構改變圖
 別構劑
別構劑Hb與O2的結合呈正協同效應
由於Hb亞基間的次級鍵限制了亞基肽段的移動,所以第一個亞基與O2結合時,肽段的移動最為因難,第二及第三個亞基與O2結合時肽段移動相對容易些,到第四個亞基與O2結合時,已沒有了束縛。因此Hb的氧飽和曲線呈S形。
Hb的運O2功能通過R態和T態構象的互變實現
參考連結
[1]http://jpkc.gdmc.edu.cn/biochemistry/htm/151dot3.htm
