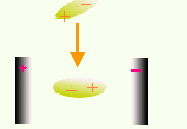
分子間力實質是分子偶極間的電引力。分子間力源於分子的極化。
1.分子的極化
在電場作用下,分子極性的變化有三種情況 :
(1)固有偶極
極性分子具有的極性,與電場無關。在電場中,極性分子的固有偶極取向發生取向極化
 分子間力
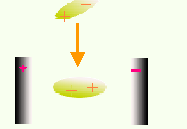
分子間力(2) 誘導偶極
外電場作用下,分子發生變形極化,產生誘導偶極,使分子的極性增加。電場撤去,誘導偶極消失。
 分子間力
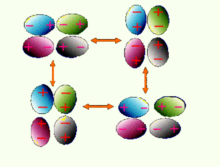
分子間力(3) 瞬時偶極
分子中原子的電子和核的相對運動會使分子發生瞬時的變形而產生瞬時偶極。 瞬時偶極總是以異極相鄰狀態存在。存在時間極短,卻反覆發生。
 分子間力
分子間力2.分子間力
(1) 非極性分子間——色散力
非極性分子可以產生瞬時偶極,瞬時偶極必定採取異極相鄰狀態,此狀態不斷重複而產生的吸引力就是色散力。
(2) 極性分子和非極性分子間——誘導力
極性分子作為電場使非極性分子變形而產生誘導偶極。固有偶極和誘導偶極間的吸引力是誘導力。
(3)極性分子間——取向力 極性分子的固有偶極間因取向而產生的引力叫取向力。
3.分子間力的特徵
(1) 是弱作用力。比化學鍵小1-2個數量級。 如:H2O中,分子間力47.28 kJ·mol-1,而E(OH) = 463kJ·mol-1
(2) 是近距離力。在300pm-500pm間有效,而且與r7成反比。
(3) 無方向性和飽和性。
分子的極性不同,三種力的比例也不同,但色散力是主要的, 存在於一切分子之間。其強度與分子的大小有關,隨分子量的增大而增大。
化學鍵和分子間的作用力
一、化學鍵:1,含義:分子或晶體內相鄰原子(或離子)間強烈的相互作用。
2,類型,即離子鍵、共價鍵和金屬鍵。
離子鍵是由異性電荷產生的吸引作用,例如氯和鈉以離子鍵結合成NaCl。
(1),使陰、陽離子結合的靜電作用
(2),成鍵微粒:陰、陽離子
(3),形成離子鍵:a活潑金屬和活潑非金屬
b部分鹽(Nacl、NH4cl、BaCo3等)
c強鹼(NaOH、KOH)
d活潑金屬氧化物、過氧化物
(4),證明離子化合物:熔融狀態下能導電
共價鍵是兩個或幾個原子通過共用電子
(1),共用電子對對數=元素化合價的絕對值
(2),有共價鍵的化合物不一定是共價化合物
對產生的吸引作用,典型的共價鍵是兩個原子借吸引一對成鍵電子而形成的。例如,兩個氫核同時吸引一對電子,形成穩定的氫分子。
(1),共價分子電子式的表示,P13
(2),共價分子結構式的表示
(3),共價分子球棍模型(H2O-折現型、NH3-三角錐形、CH4-正四面體)
(4),共價分子比例模型
補充:碳原子通常與其他原子以共價鍵結合
乙烷(C-C單鍵)
乙烯(C-C雙鍵)
乙炔(C-C三鍵)
金屬鍵則是使金屬原子結合在一起的相互作用,可以看成是高度離域的共價鍵。
二、分子間作用力(即范德華力)
特點:a存在於共價化合物中
b化學鍵弱的多
c影響熔沸點和溶解性--對於組成和結構相似的分子,其范德華力一般隨著相對分子質量的增大而增大。即熔沸點也增大(特例:HF、NH3、H2O)