簡介
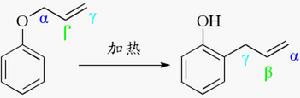 克萊森重排反應
克萊森重排反應機理
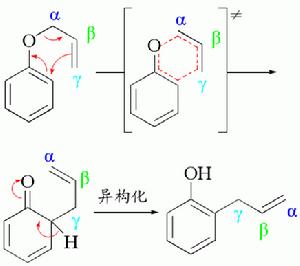 克萊森重排反應機理
克萊森重排反應機理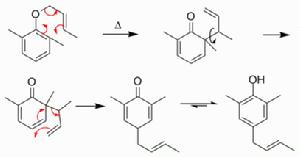 鄰位被堵住,則重排到對位
鄰位被堵住,則重排到對位審視整個過程可以看到:克萊森重排反應的驅動力是生成熱力學穩定的取代度最大的“烯烴”。
交叉反應表明:克萊森重排是嚴格的分子內反應。用碳14標記的烯丙基醚(標記γ碳)為反應原料,重排後碳14原子與苯環相連,雙鍵位置發生轉移。兩個鄰位上都有取代基的烯丙基酚,發生兩次重排後,則恢復了原來位置,則仍是α碳原子與苯環相連。
拓展
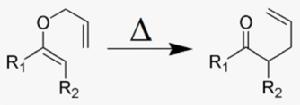 拓展的克萊森重排反應
拓展的克萊森重排反應在醚類化合物中,如果存在烯丙氧基與碳碳雙鍵相連的結構,就有可能發生克萊森重排。
現代有機合成在克萊森反應的啟發下催生出了眾多的“變體”:包括貝勒斯(Bellus)變體、埃申莫瑟(Eschenmoser)變體、艾蘭德(Ireland)變體和強生(Johnson)變體等。
異常克萊森重排反應
簡介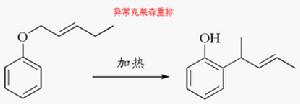 異常克萊森重排
異常克萊森重排正常克萊森重排是直接得到醇或者酚,而異常克萊森重排是先得到酮,再發生氫轉移,同時伴隨烯丙基的重排,最終生成酚。機理
首先發生正常的克萊森重排,然後經過三元環中間體,得到產物:
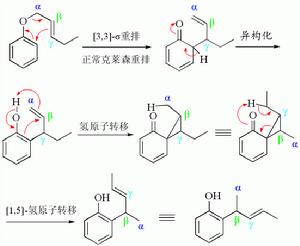 異常克萊森重排的機理
異常克萊森重排的機理自然界中的存在
 分支酸到預苯酸
分支酸到預苯酸