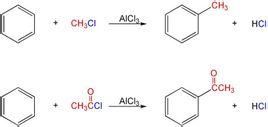
傅-克醯基化反應
傅-克醯基化反應是在強路易斯酸做催化劑條件下,讓醯氯與苯環進行醯化的反應。此反應還可以使用羧酸酐作為醯化試劑,反應條件類似於烷基化反應的條件。醯化反應比起烷基化反應來說具有一定的優勢:由於羰基的吸電子效應的影響(鈍化
基團),反應產物(酮)通常不會像烷基化產物一樣繼續多重醯化。而且該反應不存在碳正離子重排,這是由於醯基正離子可以共振到氧原子上從而穩定碳離子(不同於烷基化形成的烷基碳正離子,正電荷非常容易重排到取代基較多的碳原子上)。生成的醯基可以用克萊門森還原反應、沃爾夫-凱惜納-黃鳴龍還原反應或者催化氫化等反應轉化為烷基。優點是產物較純。
常用的醯基化試劑
醯鹵,此外還可以用酸酐甚至羧酸。
實例
比如甲醯氯就由於不穩定而不能進行,因此合成苯甲醛就需要其他的方法,如Gattermann-Koch反應:在氯化鋁和氯化亞銅的催化下,通過苯、一氧化碳與氯化氫在高壓當中合成。
實際套用
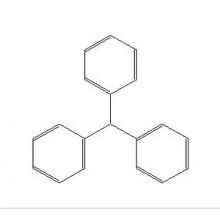 三苯基甲烷
三苯基甲烷Friedel–Crafts反應套用於很多染料的合成,比如:三苯基甲烷和氧雜蒽染料。如同克萊森重排的發展一樣,傅-克醯基化反應先是在芳香族化合物的反應中發現和套用,而後來發現該反應同樣適用於非芳香族化合物(主要是烯烴)。比如環己烯與乙醯氯在三氯化鋁的作用下生成共軛環己烯基酮,而這個方法已經發展為一種重要的合成共軛不飽和酮的方法(Nenitzescu反應)。
比如在天然產物kelsoene的一種合成方法中就利用了分子內非芳香Friedel–Crafts反應。
非芳香族化合物中發生的傅克烷基化反應也很常見。最常見的是分子內發生的傅克烷基化反應(但往往冠以其他稱呼,比如說陽離子成環反應之類,本質上就是傅-克反應的一種變體。)
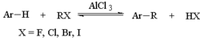
傅-克烷基化
芳烴與鹵代烴、醇類或烯類化合物在Lewis催化劑(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF等)存在下,發生芳環的烷基化反應。
 傅-克反應
傅-克反應鹵代烴反應的活潑性順序為:RF > RCl > RBr > RI ; 當烴基超過3個碳原子時,反應過程中易發生重排。
反應
反應機理
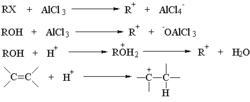
首先是鹵代烴、醇或烯烴與催化劑如三氯化鋁作用形成碳正離子:
 傅-克反應
傅-克反應所形成的碳正離子可能發生重排,得到較穩定的碳正離子:
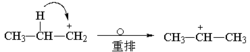 傅-克反應
傅-克反應碳正離子作為親電試劑進攻芳環形成中間體s-絡合物,然後失去一個質子得到發生親電取代產物:
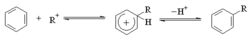 傅-克反應
傅-克反應