三氯化金也稱氯化金,化學式AuCl3,分子量303.33。紫紅色晶體。密度3.9g/cm3,熔點254℃(分解),沸點265℃(升華)。易潮解。溶於水、乙醇和乙醚中,不溶於二硫化碳。二水合物AuCl3·2H2O是橙色晶體。有氧化性。用於鍍金、藥物、攝影。由王水作用於金 或 將金跟過量氯氣於200攝氏度共熱製得。 分子結構
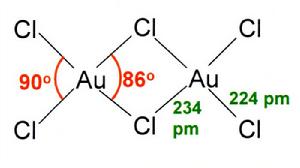
氯化金(III)或三氯化金,俗稱氯化金,是最常見的無機金化合物,化學式是AuCl3。名稱中的羅馬數字表明金的化合價為+3,這是它聚多化合物中最為穩定的形式。金也會形會另一種化物——氯化金(I)AuCl,但它比AuCl3不穩定。另外,把金溶於王水中便會產生氯金酸(HAuCl4),有時也會非正式地稱為:「氯化金」、「三氯化金酸」或是「三水合氯化金(III)」。
氯化金(III)吸濕性很強,極易溶於水及乙醇。溫度高於160 °C或光照時會分解,並產生多種有大量配合基的複合體。
最常用的製備氯化金(III)的方法,是直接在高溫中氯化該金屬︰
2Au + 3Cl2 → 2AuCl3
三氯化金是最常見的金化合物之一,因此常用作合成許多其他金化合物的起始點。例如︰溶於水的氰化物配合物——KAu(CN)4:AuCl3 + 4KCN → KAu(CN)4 + 3KCl
金(III)鹽,特別是NaAuCl4(由 AuCl3與NaCl反應製得),可取代有毒的汞(II)鹽作為炔烴反應的催化劑。例如,通過終端炔烴的水合作用來製備甲基酮。
一般在這些條件下,酮的產量可達90%。還有一個用途是在炔烴的胺化反應中作為催化劑。近年,AuCl3開始引起有機化學家的青睞,因為它可作為其他化學反應的弱酸性催化劑,例如︰芳香烴的烷基化反應,以及把呋喃轉換成苯酚(見下)。在有機物的合成以及在製藥工業中也會用到此化學反應。例如︰2-甲基呋喃(斯而烷)可在第5位置與甲基乙烯基酮順利發生烷基化反應。
常溫下,用甲基腈中1 mole%的AuCl3隻需進行40分鐘的反應便可產生91%的產物。這個量量值得注意,因為呋喃和酮通常在酸性環境下極易發生聚合反應等的副反應。有時當炔烴存在時,會生成苯酚。
此反應中,碳原子經歷了一系列複雜的重排,產生新的芳香環。
