概述
電冶金是以電能為能源進行提取和處理金屬的工藝過程。根據電能轉化形式的不同分為電化冶金和電熱冶金兩類。
電化冶金又稱電解,是使直流電能通過電解池轉化為化學能,將金屬離子還原成金屬的過程。根據電解液不同,電化冶金分為水溶液電解和熔鹽電解;根據陽極不同又分為不溶陽極電解和可溶陽極電解,前者又稱電解提取,後者又稱電解精煉。
電熱冶金是利用電能轉變為熱能在電爐內進行提取或處理金屬的過程,按電能轉變為熱能的方法即加熱的方法不同,分為電弧熔煉、電阻熔煉、感應熔煉、電子束熔煉和等離子冶金等。
分類
電化冶金
電化冶金是利用電極反應而進行的冶煉方法,對電解質水溶液或熔鹽等離子導體通以直流電,電解質便發生化學變化,在陽極(電流從電極向電解液流動)上發生氧化反應(稱為陽極反應),而在陰極(電流從電解液流向電極)上則發生還原反應(即陰極反應)。以粗金屬作陽極,而陽極反應又是目的金屬本身的溶解反應。這一過程稱為電解精煉(或可溶性陽極電解);使用不溶性電極作陽極,對溶解於電解液中的金屬離子進行還原、分解的過程,稱為電解提取。
根據電解液性質不同,對水溶液進行電解,稱為水溶液電解;對熔鹽電解液進行電解,稱為熔鹽電解。
水溶液電解精煉,主要用於電極電位較正的金屬,如銅、鎳、鈷、金、銀等,電解液多為酸液;熔鹽電解精煉主要用於電極電位較負的金屬,如鋁、鎂、鈦、鈹、鋰、鈮等。電解質一般用氯化物、氟化物或氯氟化物體系。
水溶液電解是以金屬的浸出液作為電解液進行電解還原,使目的金屬在陰極表面上析出的冶金過程,簡稱電解提取或電解沉澱。水溶液電解是一種氧化一還原過程。體系接通直流電後,在陰極附近的離子或分子由於接受電子而被還原,在陽極處離子或分子產生電子而氧化。
熔鹽電解是以熔融鹽類為電解質進行金屬提取或金屬提純的電化學冶金過程。對於那些電位比氫負得多、比氫的超電壓也小、而不能從水溶液中電解析出的金屬.以及用氫或碳難以還原的金屬,常用熔鹽電解法製取。當今已有30多種金屬使用該法生產,其中包括全部鹼金屬和鋁。大部分鎂及各種稀有金屬。
電熱冶金
和一般火法冶金相比,電熱冶金具有加熱速度快、調溫準確、溫度高(可到2 000℃),可以在各種氣氛、各種壓力或真空中作業,金屬燒損少等優點,成為冶煉普通鋼,鐵合金.鎳、銅、鋅、錫等重有色金屬,鎢、鉬、鈮、鈦、鋯等稀有高熔點金屬,某些其他稀有金屬、半導體材料等的一種主要方法。電熱冶金消耗電能較多,只有在電源充足的條件下才能發揮優勢。
電弧熔煉是利用電能在電極與電極或電極與被熔煉物之間產生電弧來熔鍊金屬的冶金過程。直接加熱式電弧熔煉的電弧產生在電極棒和被熔煉的爐料之間,爐料受電弧直接加熱,主要用於煉合金鋼。直接加熱式真空電弧熔煉爐主要用於熔煉鈦、鋯、鎢、鉬、鈮等活潑和高熔點金屬以及它們的合金。
電阻熔煉是在電阻爐內利用電流通過導體電阻所產生的熱量來熔鍊金屬的冶金過程。按電熱產生的方式,電阻爐分為直接加熱和間接加熱兩種。
電阻—電弧熔煉是利用電極與爐料之間產生的電弧和電流通過爐料產生的電阻熱來熔鍊金屬的冶金過程,是有色金屬冶煉中套用廣泛的一種電熱冶金方法,主要用於生產鐵合金、電石、銅鋶、鎳鋶、黃磷等冶金及化工產品。
感應熔煉是利用電磁感應和電熱轉換所產生的熱量來熔鍊金屬的冶金過程。感應熔煉在感應爐內進行。
電子束熔煉是利用電能產生的高速電子動能作為熱源來熔鍊金屬的冶金過程,又稱電子轟擊熔煉。該法具有熔煉溫度高、爐子功率和加熱速度高、提純效果好的優點,但也存在金屬回收率低、比電耗大等缺點。
等離子熔煉是利用電能產生的等離子弧作為熱源來熔鍊金屬的冶金過程。該法具有熔煉溫度高、物料反應速度快的特點.常用於熔煉、精煉、重熔高熔點金屬和合金。電漿用作鎳和鎳鈷合金進行蒸發精煉,可脫出鉛、鋅、錫。高熔點金屬鈦、鈮、鉻等的重熔和提純,則採用真空等離子爐。
電冶金技術
技術概述
電冶金技術也叫濕法冶金,以區別於採用火或電的火法熔煉技術。所謂濕法冶金,就是從電解液中電沉積出金屬的過程,它是冶金工業部門提取金屬的重要方法之一,同時也是提純有色金屬和製取貴重金屬的主要方法。
電冶金與火法冶金比較,具有製品純度高,並且能處理低品位礦石或複雜多金屬礦的優點。電冶金技術的要點是將礦石經焙燒、粉碎等處理後,用酸(如鹽酸、硫酸)或鹼(如硫化鹼,即硫化鈉加氫氧化鈉)、鹽(如硫酸亞鐵)等,將礦石中的金屬鹽進行溶解,再對這種含金屬離子的電解液進行電沉積加工。這時採用的陽極是不溶性陽極,而從陰極上獲取金屬材料。當然在電解製取前還要對這種電解液進行提純,將電位較正的異種金屬離子先行取出,然後才進行所需金屬的製取。
電冶金還用於對不純有色金屬的精煉。這時的陽極則是需要提純的金屬,如銅、鎳等。通過電解加工後,從陰極上獲得的是純度很高的金屬材料,其純度通常可以達到99.99%以上。
金屬的電解冶煉和精煉提純,大部分都是在電解質的水溶液中進行的。用水溶液電解體系製取的金屬現在已經達到30多種。主要有銅、鋅、鈷、鎳、鐵、鉻、錳、鎘、鉛、銻、錫、銦、金、銀等。其中電解精煉提取的有銅、鎳、鑽、錫、鉛、汞、金、銀、銻、銦等。
除了水溶性電解質,在金屬的熔融鹽中也可以電解冶金,並且是製取鋁等重要現代工業材料的重要技術。
通過熔鹽電解大規模生產的金屬有鋁、鎂、鈉、鋰、鉀、鈣、鍶、鋇、鈹、鈾、鈦等。這些材料在國民經濟中的重要性早巳超過鋼鐵與銅、鎳、鋅等一樣,成為重要的戰略性金屬材料。
技術套用
(1)銅的電解精煉
 電冶金
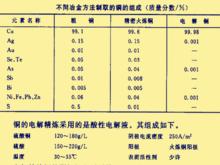
電冶金電解煉銅是工業上採用得最早的電化學方法之一,其套用也最廣。因為火法製取的銅的雜質含量太高,不適合現代工業特別是電子工業對高純度銅的需要。因此大部分(85%~90%)的銅的製取要通過電解法進行精煉。各種銅的組分如右圖所示。
電解精煉銅的陰極沉積層儘管不需要像裝飾性電鍍那樣平滑光亮,但也不能有樹枝狀或疏鬆的鍍層。因此要適當添加表面活性劑等改善陰極電流分布,使鍍層較為平整光滑。
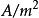 電冶金
電冶金 電冶金
電冶金 電冶金
電冶金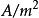 電冶金
電冶金電解精煉銅與其他電沉積銅的區別還在於它的規模是非常大的。為了提高生產效率和降低成本,電解精煉銅採用的是大規模生產方式。通常是上百個電解槽並聯或者串聯工作。所用的槽電壓也比電鍍高得多,約在16~18V。電流密度為200~260,這裡要注意與其他電沉積不同,不是採用作單位,這也是規模不同的原因。電解精煉銅的陰極板平均每塊都在左右,上百塊的總電流量非常大,這時如果仍用作單位,就會顯得很不適當。當電流效率為75%時,每噸銅的電能消耗為170~200kW·h。
銅的電冶金則是從銅礦石浸取的電解液中進行的。銅礦石的科類很多,如孔雀石、藍銅礦、黑銅礦、矽孔雀石礦、赤銅礦、輝銅礦、斑銅礦、銅藍礦和黃銅礦等。
氧化銅礦用硫酸溶解浸出;硫化礦石是用硫酸鐵溶解;含有金屬銅和氧化物的礦石可以用氨水溶液浸出;孔雀石、藍銅礦和黑銅礦可以稀硫酸溶解;赤銅礦、輝銅礦和斑銅礦則用酸化的硫酸亞鐵溶解;黃銅礦必須先在高溫煅燒使之變成氧化銅,再用酸浸出,用濕法電冶煉;銅的電冶金所用的陽極為鉛板。
(2)銀的電解精煉
 電冶金
電冶金用電解精煉銀幾乎是提純金屬銀的唯一方法。因為用這種方法製得的金屬銀,其純度可達99.96%~99.99%。電解精煉銀的電解液如右圖所示。
由於銀的電位很正,因此電解液中的其他金屬雜質的影響不眵顯。在槽電壓為1.5V,電流效率為95%時,每噸銀的電能消耗芫400kW·h。
電解銀的陽極泥中含有金、鉑等希貴金屬,還可以再用來提煉這些貴金屬。
(3)金的電解精煉
在電解銅時分離銀、銅之後的陽極泥,精煉銀以後的陽極泥中的金,由礦石冶煉中所提取的金以及廢金飾等都可以用於金的精煉提純。這些材料中除金外,尚夾雜著銅、鉛、銀、鉑族金屬雜質等。如果雜質金屬含量超過15%,則要用化學法先提純。作為陽極的金的含量不得低於90%。
金的化合物除了氯化物以外,溶解度都很低,而且還不穩定,因此都不適合作電解金的電解液。
電解金用的電解液是三氯化金加鹽酸。加入鹽酸的目的是為了增加電解液的電導,同時防止三氯化金的水解。
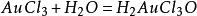 電冶金
電冶金生成的一氧三氯絡金酸按下式電離。
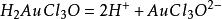 電冶金
電冶金 電冶金
電冶金因此,在中性的氯化金溶液中,主要以一氧三氯絡金酸的形式存在。這時如果以金屬金為陽極進行電解,將不是陽極的金的電化學溶解,而是氧氣的析出,結果使陽極容易鈍化。
電解精鍊金的電解槽比較小,一般只有20L,用陶瓷製作。電解液的配方如右圖所示。
電解精煉出來的金的純度可達99.98%一99.99%。
(4)鋅的濕法冶金
鋅是重要的最常用有色金屬之一。在全世界的鍍槽中,有一半左右是鍍鋅液。也就是說鍍鋅的量是所有電鍍液總量的一半。而現在世界上大約50%鋅則是通過濕法冶金製取的。
將鋅礦石用硫酸浸取,然後製成鍍鋅電解液,最後用不溶性陽極進行電沉積,從陰極上獲得金屬鋅。
工業上用電解法制鋅最早是美國和加拿大,他們於1914年開始工業電解冶煉鋅。現在濕法冶煉鋅方法與當初基本上是一樣的。只是技術和設備更加完善。
 電冶金
電冶金與前面幾種有色金屬和貴金屬不同的是,鋅的還原電位比較負,因此很多比鋅電位正的金屬都容易成為在陰極優先析出的雜質。這使得鋅的電冶金的流程和管理比較複雜。為了排除雜質金屬的干擾,在將鋅精礦經煅燒成氧化鋅後,經酸化浸製成硫酸鋅的溶液。這時要加入鋅粉,將電位比鋅正的金屬(銅、銀、金等)置換並沉澱出來。進行這種分離後的電解液,才能用於濕法冶金。
鋅的濕法冶金分為正規法和強化法兩種。正規法是將浮選得到的鋅精礦在550~650℃緩慢煅燒,然後用較低濃度的硫酸溶解(也可以用電解鋅後的電解液),製成如右圖(a)組成的電解液。
強化法是加大電解液主鹽濃度和電流密度,同時提高鍍液溫度和電流密度。這樣可以獲得較快的電沉積速度,如右圖(b)所示。
電冶金特徵
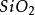 電冶金
電冶金 電冶金
電冶金簡單說來,電冶金就是電化學技術在提取冶金中的套用。十分清楚,假若一個反應消耗電子,為使該反應連續進行,就必須由另外一個反應供給電子。這一對互補反應組成一電化學電池,這兩個反應分別叫做陰極反應和陽極反應。任何一個電化學系統都表現出兩個重要特點。第一,發生電化學反應的反應物必須以帶電狀態或離子狀態存在。雖然氣體可以是帶電的原子或分子,但大多數情況下,氣態物質對組成電化學電池不甚方便。反應物只有溶解在離子固體或離子液體中,或者溶解在水這樣的極性液體中才客易電離。也就是說,這些溶劑的基本功能是為帶電物質提供一種它們能在其中存在的介質。第二,為使電化學反應在體系中連續發生,也就是使電流在回;路中流動,必須在陰、陽極之間存在電位差。產生電位差的原因,一種情況是兩個電極上的電化學反應速度不同,造成電子供應和消耗不平衡,即兩個電極表面電位有差異。另一種情況是在兩電極之間加上一外電壓。本章討論的重點是後一種情況,也兼及前一種。在電冶金反應中,對體系施以外電壓,相當於用電能做“燃料”,推動化學反應繼續進行。這種燃料的優點首推在過程中不向體系引入雜質。舉例來說,火法冶金中使用焦炭,不可避免地向反應池中引入、和硫。濕法冶金中使用的溶劑和藥劑都不可能是純物質。因此,電化學反應對於要求生產高純度和高活性材料工藝過程表現出明顯的優越性。
冶煉工藝
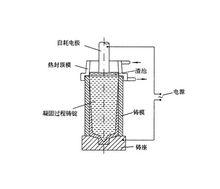 電冶金
電冶金①電爐冶煉是利用電能獲得冶金所要求的高溫而進行的冶金生產。如電弧爐煉鋼是通過石墨電極向電弧煉鋼爐內輸入電能,以電極端部和爐料之間發生的電弧為熱源進行煉鋼,可獲得比用燃料供熱更高的溫度,且爐內氣氛較易控制,對熔煉含有易氧元素較多的鋼種極為有利。
②熔鹽電解是利用電能加熱並轉化為化學能,將某些金屬的鹽類熔融並作為電解質進行電解,自熔鹽中還原金屬,以提取和提純金屬的冶金過程,如鋁、鎂、鈉、鉭、鈮的熔鹽電解生產。
③水溶液電解是利用電能轉化的化學能使溶液中的金屬離子還原為金屬析出,或使粗金屬陽極經由溶液精煉沉積於陰極,如銅、鋅的電積和銅、鉛的電解精煉。

