定義
英文名:Solubility
定義:達到 (化學)平衡的溶液便不能容納更多的溶質(當然,其他溶質仍能溶解),我們稱之為飽和溶液。如果不指明溶劑,通常意味著溶劑為水,比如“氯化鈉的溶解度”和“氯化鈉在水中的溶解度”可以認為是具有同樣的意思。溶解度並不是一個恆定的值。一種溶質在溶劑中的溶解度由它們的 分子間作用力、溫度、溶解過程中所伴隨的熵的變化以及其他物質的存 在及多少,有時還與氣壓或氣體溶質的分壓有關。因此,一種物質的溶解度最好能夠表述成:“在20度,標準氣壓下,某物質在100克水中的溶解度為xxxx。”,如無指明,則溫度及氣壓通常指的是標準狀況(STP)
溶解性是指一種物質能夠被溶解的程度。發生溶解的物質叫溶質,溶解他物的液體(一般過量)叫溶劑,或稱分散媒,生成的混合物叫溶液。
溶解度的定義:在一定溫度下,某固體物質在100g溶劑里達到飽和狀態是所溶解的質量。
如果一種溶質能夠很好地溶解在溶劑里,我們就說這種物質是 可溶的。如果溶解的程度不多,稱這種物質是 微溶的。如果很難溶解,則稱這種物質是 不溶或 難溶的。
實際上,溶解度往往取決於溶質在水中的 溶解平衡常數。這是平衡常數的一種,反映溶質的溶解-沉澱平衡關係,當然它也可以用於沉澱過程(那時它叫溶度積)。因此,溶解度與溫度關係很大,也就不難解釋了。
達到化學平衡的溶液便不能容納更多的溶質(當然,其他溶質仍能溶解),我們稱之為飽和溶液。在特殊條件下,溶液中溶解的溶質會比正常情況多,這時它便成為過飽和溶液。
關於溶劑
溶劑通常分為兩大類:極性溶劑、非極性溶劑。溶劑種類與物質溶解性的關係可被概括為:“溶其所似”。意思是說,極性溶劑能夠溶解離子化合物以及能離解的共價化合物,而非極性溶劑則只能夠溶解非極性的共價化合物。比如,食鹽,是一種離子化合物,它能在水中溶解,卻不能在乙醇中溶解。
在有機化學中一般會用到的溶劑有丙酮、乙醇、水和苯。
水以及非極性溶劑是不能互溶的,特例水和乙醇任意比互溶;如果你非要這么做,它們也不會形成均一的混合物,最終會分離為兩層,這時稱作懸濁液,又或者將油中加入相應的助劑(農藥中常用),入水後形成水包油或油包水的均一乳狀液體。
溶解性的套用
①是指物質在溶劑里溶解能力的大小。
②溶解性是物理性質,多數溶解是物理變化(也有的溶解是化學變化,比如蘇打溶於酸,發生了化學反應)。
③溶解性是由20℃時某物質的溶解度決定的。(固體)
| 溶解性 | 20℃溶解度 | 備註 |
| 難溶或不溶 | 10g |
④利用溶解性可有以下套用:
a、判斷氣體收集方法
可溶(易溶)於水的氣體不能用排水取氣法
如:CO
而H,O溶解性不好,可用排水取氣法。
b、判斷混合物分離方法
兩種物質在水中溶解性明顯不同時,可用過濾法分離。
如:KNO(易溶)與CaCO(難溶)可用過濾法分離;
而C與MnO二者均不溶NaCl、KNO均易溶,都不能用過濾法分離。
溶解度算法:溶質質量/溶劑質量(通常為水)
單位: g/100g水
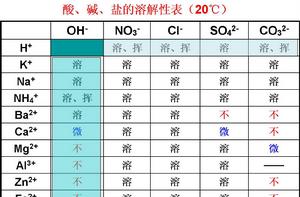
溶解性表
| OH- | NO3- | Cl- | SO4 2- | CO3 2- | |
| H+ | H2O(不屬於酸鹼鹽) | 溶、揮(硝酸) | 溶、揮(鹽酸) | 溶(硫酸) | 溶、揮(碳酸) |
| NH4+ | 溶、揮(氨水,氫氧化銨) | 溶 | 溶 | 溶 | 溶 |
| K+ | 溶(苛性鉀) | 溶 | 溶 | 溶 | 溶 |
| Na+ | 溶(氫氧化鈉) | 溶 | 溶 | 溶 | 溶 |
| Ba 2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Ca 2+ | 微(熟石灰) | 溶 | 溶 | 微 | 不 |
| Mg 2+ | 不 | 溶 | 溶 | 溶 | 微 |
| Al 3+ | 不 | 溶 | 溶 | 溶 | - |
| Mn 2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Zn 2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Fe 2+ | 不 | 溶 | 溶 | 溶 | 不 |
| Fe 3+ | 不 | 溶 | 溶 | 溶 | - |
| Cu 2+ | 不 | 溶 | 溶 | 溶 | - |
| Ag+ | - | 溶 | 不 | 微 | 不 |
說明:“溶”表示那種物質可溶於水,“不”表示不溶於水,“微”表示微溶於水,“揮”表示揮發性,“-”表示那種物質不存在或遇到水就分解了。
溶解性口訣
溶解性口訣一
①,鉀鈉銨鹽溶水快
②,硫酸鹽除去鋇鉛鈣,氯化物不溶氯化銀。
③,硝酸鹽溶液都透明。
④,口訣中未有皆下沉。
註:
①鉀鈉銨鹽都溶於水;
②硫酸鹽中只有硫酸鋇、硫酸鉛、硫酸鈣不溶;
③硝酸鹽都溶於水;
④口訣中沒有涉及的鹽類都不溶於水;
溶解性口訣二
鉀、鈉、銨鹽、硝酸鹽;
氯化物除銀、亞汞;
硫酸鹽除鋇和鉛;
碳酸、磷酸鹽,只溶鉀、鈉、銨。
溶解性口訣三
鉀鈉銨硝皆可溶、鹽酸鹽不溶銀亞汞;
硫酸鹽不溶鋇和鉛、碳磷酸鹽多不溶。
多數酸溶鹼少溶、只有鉀鈉銨鋇溶。
註:口訣中未提到的矽酸(矽酸鹽)難溶於水
溶解性口訣四
鉀、鈉、硝酸溶, (鉀鹽、鈉鹽和硝酸鹽都溶於水。)
鹽酸除銀(亞)汞, (鹽酸鹽里除氯化銀和氯化亞汞外都溶。)
再說硫酸鹽,不容有鋇、鉛, (硫酸鹽中不溶的是硫酸鋇和硫酸鉛。)
其餘幾類鹽, (碳酸鹽、亞硫酸鹽、磷酸鹽、矽酸鹽和硫化物)
只溶鉀、鈉、銨, (只有相應的鉀鹽、鈉鹽和銨鹽可溶)
最後說鹼類,鉀、鈉、銨和鋇。 (氫氧化鉀、氫氧化鈉、氫氧化鋇和氨水可溶)
另有幾種微溶物,可單獨記住。
溶解性口訣五
鉀鈉銨鹽硝酸鹽
完全溶解不困難
氯化亞汞氯化銀
硫酸鋇和硫酸鉛
四種物質不溶解
生成沉澱記心間
氫硫酸鹽和鹼類
碳酸磷酸矽酸鹽
不可溶解占多數
可溶只有鉀鈉銨
溶解性口訣六
鉀鈉銨硝溶
強溶弱不溶
溶解性口訣七:
鹼溶鉀鈉鋇鈣
鉀鈉銨硝全溶
碳酸鹽溶鉀鈉銨
鹽酸鹽除銀不溶
硫酸鹽除鋇銀不溶
特例:1.高氯酸的鉀、銣、銫鹽溶解度很小.
2.高氯酸銀溶解度很大,5570 g/L
3.氟化銀溶於水,且溶解度較大.1800 g/L
4.四苯硼鉀、三鈦酸鈉、重鈾酸銨不溶於水。