稀溶液的依數性
正文
非揮發性溶質溶解在溶劑中後,其稀溶液的蒸氣壓下降、沸點升高、冰點降低、滲透壓等值只與溶質的分子數有關而與溶質的種類無關,這四種性質稱為稀溶液的依數性。蒸氣壓下降 拉烏爾定律描述了非揮發性溶質溶解在溶劑中所引起的溶劑蒸氣壓下降:
ΔpA=p┱xB (1)
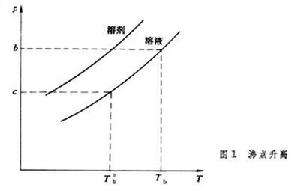
式中ΔpA為溶劑的蒸氣壓下降值;p┱為純溶劑的蒸氣壓;xB為溶質的摩爾分數。式(1)說明蒸氣壓下降只與溶質的摩爾分數有關,與溶質的種類無關。沸點升高 液體蒸氣壓等於外界壓力時的溫度稱為沸點,外壓為1大氣壓時的沸點稱為正常沸點。圖1
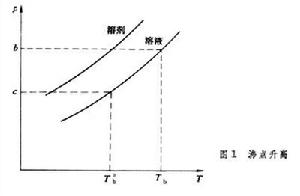 繪出溶液和純溶劑的蒸氣壓曲線,在溶劑的沸點T
繪出溶液和純溶劑的蒸氣壓曲線,在溶劑的沸點T 下,溶劑的蒸氣壓為b,溶液的蒸氣壓為c。欲使溶液的蒸氣壓達到b,必須將溫度升高到Tb,Tb與T
下,溶劑的蒸氣壓為b,溶液的蒸氣壓為c。欲使溶液的蒸氣壓達到b,必須將溫度升高到Tb,Tb與T 之差稱為稀溶液的沸點升高:
之差稱為稀溶液的沸點升高: 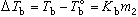 (2)
(2) 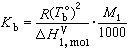 (3)
(3)
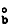 為溶劑的正常沸點;Tb為溶液的沸點;Μ1為溶劑的相對分子量;
為溶劑的正常沸點;Tb為溶液的沸點;Μ1為溶劑的相對分子量;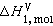 為溶劑的摩爾氣化熱。式 (3)說明沸點升高常數只是決定於溶劑的常數,因此, 當溶劑一定時沸點升高只與溶質物質的量有關,而與其他性質無關。
為溶劑的摩爾氣化熱。式 (3)說明沸點升高常數只是決定於溶劑的常數,因此, 當溶劑一定時沸點升高只與溶質物質的量有關,而與其他性質無關。 1871年 F. -M. 拉烏爾從實驗中發現沸點升高關係,1886年J.H.范托夫從熱力學角度導出式(2),1889年E.O.貝克曼設計了更精確的實驗加以證實。
冰點降低 冰點是固態純組分1與溶液中的組分1達到兩相平衡時的溫度,即固態純組分1的蒸氣壓與液態純組分的蒸氣壓相等時的溫度。圖2
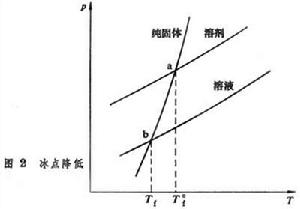 繪出溶劑、溶液、純固體的蒸氣壓曲線,溶劑與純固體的蒸氣壓曲線在a點相交,對應的冰點為T懤;溶液與純固體的蒸氣壓曲線在b點相交,對應的冰點為Tf,二者之差稱為冰點降低:
繪出溶劑、溶液、純固體的蒸氣壓曲線,溶劑與純固體的蒸氣壓曲線在a點相交,對應的冰點為T懤;溶液與純固體的蒸氣壓曲線在b點相交,對應的冰點為Tf,二者之差稱為冰點降低: ΔTf=T懤-Tf=Kfm2 (4)
 (5)
(5)
 為1摩爾的溶劑由固態轉變為液態的熔化熱。式(5)說明Kf只與溶劑的種類有關,因此,冰點降低只與溶質物質的量有關,而與溶質的種類無關。
為1摩爾的溶劑由固態轉變為液態的熔化熱。式(5)說明Kf只與溶劑的種類有關,因此,冰點降低只與溶質物質的量有關,而與溶質的種類無關。 1788年C.布萊格登發現冰點降低關係式(4),曾一度被稱為布萊格登定律。1886年范托夫從熱力學角度給予嚴格證明,導出式(5)。
冰點降低可用於測定未知物的相對分子量:
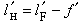 (6)
(6)
滲透壓 用半透膜將純溶劑和稀溶液或稀溶液和濃溶液隔開後,溶劑分子能從溶劑一邊進入溶液一邊的現象稱為滲透。1827年法國生理學家H.迪特羅謝最早引入這一概念。滲透壓指為阻止溶劑分子滲透而在溶液上方所需要施加的額外壓力。1877年德國植物學家W.普菲費爾首次制出人工半透膜,並測定了蔗糖水溶液的滲透壓。范托夫分析了普菲費爾的實驗數據,於1886年提出滲透壓公式:
 (7)
(7)
用沸點升高和冰點降低法測定膠體溶質的相對分子量時,誤差較大,所以常用滲透壓法測定。滲透壓對研究動、植物體的生命過程也有重要意義。