正文
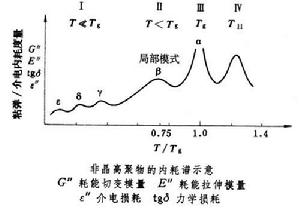
非晶高聚物在升溫或降溫過程中可以在流動態-橡膠態-玻璃態之間進行轉變和鬆弛,此時在動態力學性能上(如耗能切變模量、耗能拉伸模量、力學損耗)會出現粘彈內耗峰;當主鏈中或側基上有極性基團時,則在動態介電性能上(如介電損耗)會出現介電內耗峰;在溫度坐標上多個內耗峰便可構成內耗譜。典型的粘彈和介電內耗譜如圖所示。圖中分為四個區域(不包括化學轉變)。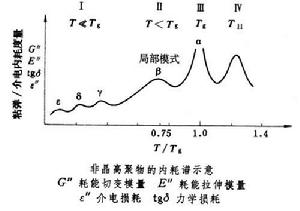 非晶高聚物的轉變和鬆弛
非晶高聚物的轉變和鬆弛玻璃化轉變或α鬆弛 即橡膠態與玻璃態之間的轉變(圖中第Ⅲ區),是由較長鏈段運動的凍結或解凍所引起的,每個鏈段約包括10~20個鏈節。運動凍結時的玻璃化溫度以Tg表示。玻璃化轉變的內耗峰比其他的都高大,故可作為主轉變,以與其他次轉變相區別,並可將Tg作為參比溫度。
當結晶性高聚物的熔體冷卻時,長程分子鏈段運動被凍結住,即能形成玻璃態,這種玻璃態在X射線衍射圖上不顯示長程有序,因此不是結晶。
某一給定高聚物的分子量較小時,Tg值依賴於分子量,若分子量高到某一限值時,Tg值即趨於恆定,故這種轉變或鬆弛是鏈段運動而不是整鏈運動。對結構不同的高聚物,決定Tg值高低的主要因素是鏈間的作用力和主鏈的柔曲性。作用力大或鏈僵硬,都能使Tg增高。交聯使Tg增高,增塑劑使Tg降低,無規共聚物的Tg在其相應的均聚物的Tg之間。所測得的Tg的高低還依賴於測試頻率,這是鬆弛的特徵,而不是熱力學上的二級轉變。高分子鏈完全停止運動時的溫度稱為T2,其值比Tg要低50°C左右。Tg值為180~450K時,活化能為80~500千焦/摩爾。
許多高聚物在玻璃化溫度時具有一些共同的特徵,如處於等粘度狀態(粘度為1010~1012泊),等自由體積狀態(如 Δα·Tg≈0.113,式中Δα 為液態的與玻璃態的熱膨脹係數之差),以及等熵、等熱焓、等擴散狀態等等。這方面的研究發展了相應的玻璃化轉變理論,如自由體積理論、熱力學理論、圓珠-彈簧模型分子理論等。
在玻璃態中發生的次轉變和鬆弛 在 T<Tg的溫區中(圖中第Ⅱ、Ⅰ 區),按溫度下降順序可稱為β、γ、δ、ε等鬆弛。其運動單元比主轉變的為小,對內耗峰的貢獻也低,活化能也依次降低。
液態中的轉變
20世紀70年代中期,在T>Tg的溫區中(圖中第Ⅳ區),還發現從某一種液態轉變為另一種液態的轉變,其溫度用T11表示,這是由頗長的鏈段乃至整個鏈的運動所引起的,是流動的前奏,T11(K)與Tg(K)之比值在1.1~1.2之間。
化學反應與內耗譜
上述物理轉變和鬆弛都假設在過程中不發生化學轉化。若發生高分子化學反應,高聚物在結構和性能上將導致激烈的改變,也能在力學內耗譜和模量譜中反映出來。例如高分子的交聯和裂構反應都能出現內耗峰,但模量變化則相反,交聯使模量增高,裂構使模量降低。如果以預聚物聚合成為高聚物,Tg將隨分子量的增高而提高,或隨新產物的生成而改變,因而Tg是時間和溫度的函式。(見高聚物粘彈性、高聚物介電性能)
參考書目
錢保功、許觀藩、余賦生等著:《高聚物的轉變與鬆弛》,科學出版社,北京,1986。