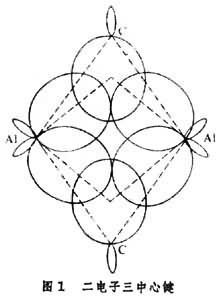
金屬有機物的鍵型
正文
金屬有機物的金屬-碳鍵大體上可有四種類型。離子鍵型 離子鍵是以金屬正離子為一方,烴基負離子為另一方,依靠正負離子的靜電作用結合而成。離子鍵型金屬有機物是由電正性很強的、化學性質特別活潑的鈉、鉀、鍶、鋇等金屬元素和烴基成鍵的化合物。烷基鈉等通常是無色的,外形象鹽;不溶於非極性有機溶劑如苯和四氯化碳等;離子性很強,烷基負離子的化學性質特別活潑,極易被水分解,對空氣敏感;能導電。
較為穩定的烴基負離子如烯丙基、苄基、三苯甲基,和鉀、鈉正離子形成的烴基金屬有機物能溶於乙醚。這類負離子帶有顯著的顏色,烴基的負電荷得到分散,金屬正離子在乙醚溶液中被溶劑化,使這類離子性烴基金屬較為穩定,可以結晶出來,未結晶前在溶液中有導電性。
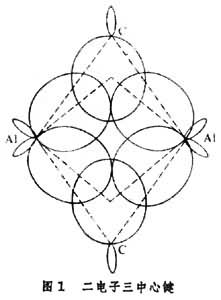 金屬有機物的鍵型
金屬有機物的鍵型σ共價鍵型 碳原子和金屬原子各出一個電子,配對形成共用的一對電子,即有機化合物中的單鍵。一個金屬原子提供電子成單鍵的數目就是該金屬的化合價。共價鍵型金屬有機物的分子式為RnM,一般能溶於有機溶劑,不溶於水,有揮發性,在溶液中不易導電。形成σ共價鍵型的活潑金屬有機化合物能締合併藉助多中心鍵形成聚合物(RnM)x(x=2、4、6、…);不活潑的金屬有機物只以單體狀態存在。
金屬原子用sp雜化軌道與兩個烴基共價結合的化合物為直線型分子;用sp2雜化軌道與三個烴基結合,形成平面三角型分子;用sp3雜化軌道與四個烴基成鍵,形成四面體型分子。它們大多數是非過渡金屬和烴基形成的化合物。
π共價鍵型 是利用金屬的(n-1)d軌道或其s、p、d 雜化軌道與碳原子的價鍵軌道重疊而成的共價鍵。一般,有機化合物的雙鍵或叄鍵是利用碳原子的p軌道相互側面重疊,與σ 鍵往往同時存在於兩個碳原子之間。金屬的p軌道能量高,不易與碳原子的p軌道重疊;金屬的(n-1)d軌道能量較低,過渡金屬原子的(n-1)d軌道中有電子而又不滿,容易與碳原子的p軌道重疊。
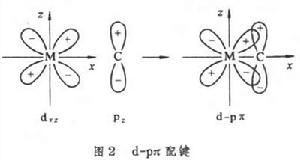
金屬原子的d軌道與某些有電子對的元素原子p軌道在形成σ 鍵之外也組成不牢固的π 鍵,叫d-pπ 鍵。這裡p軌道上的電子對配給另一原子的空d軌道,也可以叫d-pπ配鍵(圖2)。
 金屬有機物的鍵型
金屬有機物的鍵型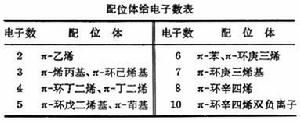 金屬有機物的鍵型
金屬有機物的鍵型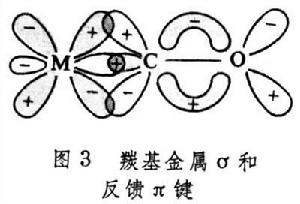 金屬有機物的鍵型
金屬有機物的鍵型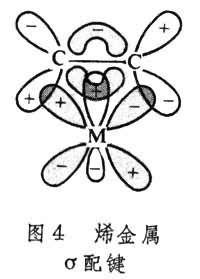 金屬有機物的鍵型
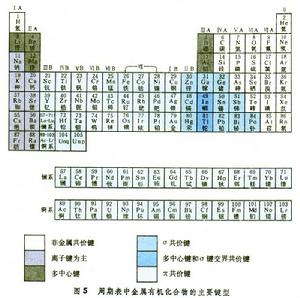
金屬有機物的鍵型具有特種鍵型的金屬有機物的金屬在周期表上分布如圖5,這一分布不是絕對的,同一種金屬有機物可能兼有兩種以上的鍵型。
 金屬有機物的鍵型
金屬有機物的鍵型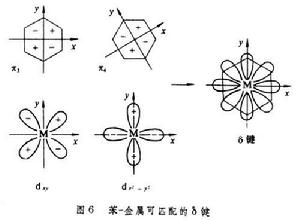 金屬有機物的鍵型
金屬有機物的鍵型參考書目
J.C.Bailar Jr., et al.,Comprehensive Inorganic Chemistry,Pergamon, London, 1973.