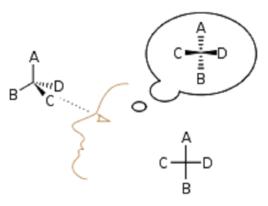
研究簡史
四面體構型
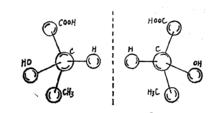 球棍模型
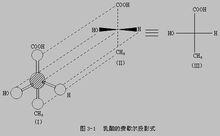
球棍模型對於對映異構現象,一般的平面結構式如乳酸的分子式CH3CH(OH)COOH,無法表示它的基團在空間的相對位置。最開始只有直觀的構型式或球棍模型才能表示出這種區別。例如,乳酸的四面體構型如右圖所示。
楔線式
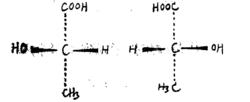 楔形式
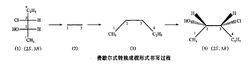
楔形式隨著范特霍夫(Van't Horff)於1874年提出了碳原子的四面體學說,藉助某一化合物與其鏡像的四面體空間結構,發現有些分子的實物與其鏡像是可以重合的,但也有些分子的實物與其鏡像是對映而不重合的,如右圖所示的如雙分子的兩個四面體空間結構,如果將甲基和羧基分別重疊是,剩下的氫原子和羥基就不能重疊。 為了在紙平面上表示出上述四面體的立體結構,就採用立體模型式,也稱為楔形式。這種式子的優點是生動、形象、清楚,但書寫起來比較困難,對於結構比較複雜的分子,更增加了書寫的難度。
投影式
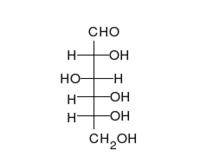
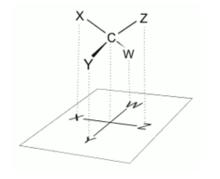 四面體型分子投影式被投影至平面上變成費歇爾投影式
四面體型分子投影式被投影至平面上變成費歇爾投影式為了方便書寫和比較,特別是對於含有多個手性碳原子的糖化物和胺基酸等有機分子,德國化學家費歇爾(Fischer E)於1891年,首次提出一種用二維圖象和平面式子表示三維分子立體結構的重要方法——費歇爾投影式。 右圖即為四面體型分子投影式被投影至平面上變成費歇爾投影式。
當時,他正根據范特霍夫(Van’t Hoff)和勒貝爾(Le Bel)的立體異構理論,用氧化、還原、降解、加成等方法,確定並費歇爾投影式書寫了D-系列已醛糖由於對映異構所導致的共16種的構型。
費歇爾投影式不僅簡化了書寫,而且還方便費歇爾使用他參照化合物D-或L-甘油醛而發明的D/L相對構型命名法。此外,費歇爾投影式也適用於1970年IUPCA所規範的R/S絕對構型命名法。
哈沃斯透視式
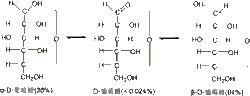 D-葡萄糖的變旋平衡
D-葡萄糖的變旋平衡費歇爾投影式在表示單糖的環狀結構,如右圖表示六元環的D-葡萄糖時,存在不能準確地反映環中氧橋(oxo bridge)的長度和成環時繞C和C之間的鍵發生旋轉的事實的問題。可以看到氧橋顯得太長,而且無法表明葡萄糖的C的氫原子和C的氫原子在不同側。
於是,1926年英國化學家W.Haworth(1883-1950)發明並推薦使用一種專門表示單糖、雙糖或多糖所含單糖環形結構的透視式,被稱為哈沃斯透視式(投影式),簡稱哈沃式。
哈沃式中己醛糖的吡喃環用一個垂直於紙平面的六角形環面表示,環中省略了構成環的碳原子,濃粗的環邊表示向著讀者細線的含氧橋環邊表示離開讀者。
定義內容
概念辨析
有機物的同分異構現象可分成兩大類:構造異構和立體異構。其中,立體異構又包括順反異構、對映異構和構象異構三種情況。而費歇爾投影式主要用於對映異構的書寫,對映異構體是分子式相同,構造式相同,但構型不同,互為鏡象但不能重合的立體異構體。 從構象上分析,費歇爾式都是不穩定的重疊式構象,因此,在進行構象分析時不用費歇爾式。
投影規則
 乳酸的費歇爾投影式
乳酸的費歇爾投影式為了作出統一的分子構型表達式,費歇爾曾制定了三條投影規則 :
(1)將碳鏈放在垂直線上或豎起來,把氧化態較高的碳原子或命名時編號最小(主鏈中第一號)的碳原子C放在最上端。
(2)投影時假定手性碳原子放在紙平面上,與垂直線(vertical line)相連的原子或基團(垂直方向的鍵 /豎鍵)表示伸向紙面後方,即遠離讀者;與水平線(horizonal line)相連的原子或基團(水平方向的鍵 /橫鍵)表示伸向紙面前方,即伸向讀者。 “橫前豎後”規則是費歇爾式最基本的硬性規定。
(3)手性碳位於橫線與豎線交叉處,用一個“+”號的交點代表手性碳原子。四端與四個不同的原子或基團相連,一般總是把含碳原子的基團放在豎線相連的位置上。
在書寫糖類時,羰基一般寫在鏈的上端,羥甲基寫在下端,氫原子和羥基位於鏈的兩側。 對於含兩個相鄰手性碳的費歇爾式,主鍵為兩手性碳之間的鍵,共平面為費歇爾式的豎線。即主鍵和共平面都在同一豎線上並垂直於紙面,而兩個碳原子分別在兩個平行的紙面上。
書寫注意
費歇爾投影式嚴格表示了各個原子或基團空間與平面的關係,所以使用時應注意以下事項。同時,也可以逆用這些規則來判別不規範的費歇爾投影式之間,是同一種構型還是對應異構體,下面就用氟氯溴碘化碳(假想物)舉例子。
(1)某一個化合物的費歇爾投影式只能在紙平面上平移,投影式不能離開紙平面翻轉180°,否則一對對映體的投影式便能相互重疊。
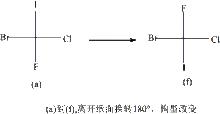 不能離開紙平面翻轉
不能離開紙平面翻轉(2)費歇爾投影式在平面內轉動180°,不改變分子的構型。而且只有轉動180°,才不改變基團的前後關係。 若將其中一個費歇爾投影式在紙平面上旋轉180°後,得到的投影式和另一投影式相同,則這兩個投影式表示同一構型。
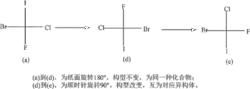 費歇爾投影式在平面內轉動180°,不改變分子的構型
費歇爾投影式在平面內轉動180°,不改變分子的構型(3)如果未特別指出,不能在紙平面上旋轉90°或270°(奇數倍),否則會改變投影式的構型。若將其中一個費歇爾投影式在紙平面上(順時針或逆時針)旋轉90°後,兩個投影式表示兩種不同構型,二者是一對對映體。
(4)若將其中一個費歇爾投影式的手性碳原子上的任意兩個原子或基團交換偶數次後,得到的投影式和另一投影式相同,則這兩個投影式表示同一構型,如下圖所示。若將其中一個費歇爾投影式的手性碳原子上的任意兩個原子或基團內部互變,或者交換奇數次後,所得的費歇爾投影式表達的化合物是原化合物的對映體。
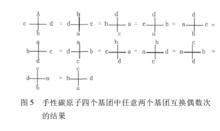 任意兩個原子或基團交換偶數次後,得到的投影式和另一投影式相同
任意兩個原子或基團交換偶數次後,得到的投影式和另一投影式相同(5)在投影式中,固定任一基團不動,其餘三個基團按順時針或逆時針順序依次交換位置,其構型不變。如下圖所示。
 固定一個基團不動,其餘基團按時針順序依次交換位置,其構型不變
固定一個基團不動,其餘基團按時針順序依次交換位置,其構型不變判定構型
相較於構象鋸架式(以下簡稱鋸架式)或紐曼投影式(以下簡稱紐曼式)來表示具有手性碳原子的化合物,費歇爾投影式更容易確定化合物的構型,並其進行命名。
D、L構型
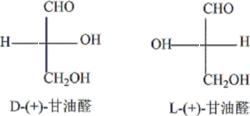 甘油醛的D、L構型
甘油醛的D、L構型1951年,費歇爾採用(+)-甘油醛為標準物,並人為地規定在費歇爾投影式中第二號碳原子C上的羥基,位於右側的為D構型,位於左側的為L構型。所以,D/L構型又稱為相對構型。 右圖為用費歇爾投影式表示的甘油醇的D/L構型,並標出了碳的序號。
 參照甘油醛的構型的化合物
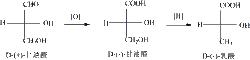
參照甘油醛的構型的化合物其他對映異構體的構型通過與甘油醛進行直接或者間接對比來確定。只要在反應中,不涉及與手性碳原子相連線的化學鍵的斷裂與形成,那么所得化合物的構型與原來甘油醛的構型相同。
例如右圖,參照甘油醛的構型,甘油酸和乳酸的構型也是D構型。進一步來說,甘油酸在經溴水氧化成乳酸後,因為該反應只發生在C上,沒有改變與手性碳原子相連的-H和-OH的空間排布,因而與甘油醛具有相同的構型。
但需要注意的是,D-甘油醛是右旋的,而D-甘油酸卻是左旋的。旋光方向發生了改變,說明化合物的構型與旋光方向沒有任何對應關係,費歇爾投影式也無法直接標識出一種物質的旋光性。當然,對於一對對映異構體而言,如果確定D-構型是左旋體,那么有L-構型一定是右旋體,反之亦然。
但由於D、L構型值適用於一個手性碳原子的化合物,對於含有多個手性碳原子的化合物存在局限性。但由於習慣,僅在胺基酸和糖類中尚在使用D、L構型標記系統。因此,1970年IUPAC建議採用R/S構型標記法,這種方法是直接對化合物立體結構的費歇爾投影式進行構型標記。
R、S構型
在楔形透視式觀察法中,將排序最後的原子或基團放在離觀察者最遠的位置,剩餘三個原子或基團排序確定手性碳構型:按順時針方向排列為R-構型;按逆時針方向排列為S-構型。類似地,知道一個化合物分子的費歇爾投影式,可以利用它來確定手性碳化合物的R、S構型。下面分兩種情況來討論。
(1)若優序性最小的基團,位於投影式的上方或下方,可以直接從紙平面上判斷它的構型。因為,豎線上的基團位於觀察者最遠的位置,這時優序性較大的三個基團在空間的實際排列形狀與它們在投影式中的排列形狀是一致的。
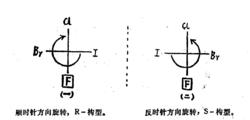 優序性最小的基團位於下方,直接判斷它的構型
優序性最小的基團位於下方,直接判斷它的構型在(一)式中,-F是優序性最小的基團,它位於投影式的下方。其餘各個基團的優序性降序排列為:-I>-Br>-Cl,從圖中可以看出按順時針方向旋轉。因此,(一)式為R-構型。根據同樣的方法可以判定,(二)式為S-構型。
將費歇爾投影式在紙平面上旋轉180°得到下圖,同理右邊為R-構型,左邊為S-構型。這也驗證了構象相同判據(1)的正確性。
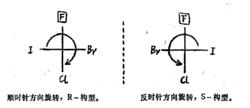 優序性最小的基團位於上方,直接判斷它的構型
優序性最小的基團位於上方,直接判斷它的構型(2)若優序性最小的基團位於投影式的左方或右方,這一點其實尤為重要,因為通常氫原子最小且寫在投影式的左右。
這時,它們的構型不能直接從紙平面上來制定,可以採用交換法:將優序性最小的基團-F和位於投影式上方或下方的基團交換位置,如下圖所示。
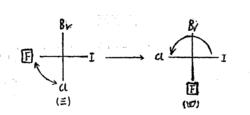 優序性最小的基團位於投影式的左方或右方
優序性最小的基團位於投影式的左方或右方(四)式的構型可以直接判定,是S-構型。(三)式和(四)式的區別在於-F和-Cl兩個基團交換了位置。根據書寫費歇爾投影式注意事項(2)可知,它們互為對映體。既然,(四)式為S-構型,因此,可以判定:(三)式為R-構型。
將這個規律歸納為反推法:與當優序性最小的基團在投影式的左方或右方時,其餘三個基團在空間的實際排列形狀與它們在投影式中的排列形狀剛好相反。在(三)式中,序性較大的三個基團的降序旋轉方向從-I-Br-Cl為逆時針方向,是S-型,但優序性最小的基團-F位於投影式的左方,所以需要反推一次,故原物質的構型為R-型。
此外,還可以用形象地用手型比劃:排序最後的原子或基團用手臂代表,在橫線左方的用左臂,在橫線右方的用右臂,拇指代表另一橫線方向上的原子或基團;此時掌心面對觀察者,即手臂轉到離觀察轉到觀察者最遠的位置,拇指、食指、中指都指向觀察者,食指朝上代表上方原子、中指朝下代表下方原子,最後拇指、食指、中指所代表原子或基團的排序確定其構型。 下圖為常見的基團次序表:
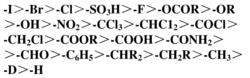 基團次序表
基團次序表蘇型與赤型
蘇型與赤型概念來自於糖類化學中的蘇阿糖和赤蘚糖。它們的費歇爾投影式及名稱如下:
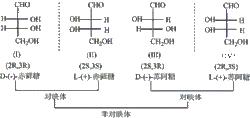 蘇阿糖和赤蘚糖
蘇阿糖和赤蘚糖在丁醛糖的四個旋光異構體中,(I)和(II)、(I)和(IV)呈實物和鏡像對映而不重合的關係,各構成一對對映體。而(I)和(III)、(I)和(IV)、(II)和(III)、(II)和(IV)不呈實物和鏡像的對映關係,像這種不呈實物和鏡像對映關係的旋光異構體稱為非對映異構體,簡稱非對應異構體。非對映異構體的比旋光度大小和方向均不同,其他物理性質如熔點、沸點、溶解度也不一樣。
如果兩個不同的手性碳原子含有一個相同的原子或基團,習慣上把它們與丁醛糖的四個旋光異構體作比較來標記其構型,分為蘇型和赤型。
蘇型
兩個相同原子或基團位於費希爾投影式異側者,類似蘇阿糖的構型,稱為蘇型或蘇式(threo-)。例如(-)-氯黴素是蘇式。
赤型
兩個相同原子或基團位於費希爾投影式同側者,類似赤蘚糖的構型,稱為赤型或赤式(erythro-)。
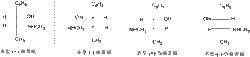 麻黃鹼和偽麻黃鹼蘇式和赤式
麻黃鹼和偽麻黃鹼蘇式和赤式如從中藥麻黃鹼中提取的生物鹼有麻黃鹼和偽麻黃鹼, 它們的兩個手性碳原子含有一個相同的氫原子,可以用赤型或蘇型來標記它們的構型。
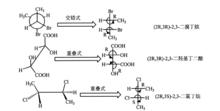
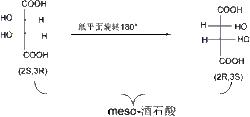 meso 酒石酸
meso 酒石酸但是有種內消旋體(mesomer),常用“ meso”表示的特例,由於分子中含有兩個相同的手性碳原子,而且分子的兩部分有呈實物與鏡像對映而不重合的關係,從而使分子內部旋光性相互抵消的化合物,就無法用蘇型和赤型標識。如果分子中含有偶數個相同的手性碳原子,如酒石酸的(2S,3R)和(2R,3S)構型,從費歇爾投影式構象規則,旋轉180°不改變構型,可以發現看出(2S,3R)和(2R,3S)是同一種物質,因此酒石酸只有3種構型。
實驗測得,赤式的酒石酸沒有旋光性,因為C和C存在一個對稱面,把整個分子分成互為實物和鏡像對映而不重合關係的上下兩部分,兩個手性碳原子的旋光度大小相等,旋光方向卻相反,恰好相互抵消而沒有旋光性。
相互轉化
方位法
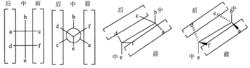
一種更加直觀地展示原子排布的方法是規定各種化學式的前中後的方位,如下圖。在轉化化學式時,兩個手性碳原子會呈現出“一一對應”的規律。即為前對前,中對中,後對後。觀察下圖的原子排布,我們知道費歇爾投影式本身表示的構象是重疊式,可以看出a,d或e,f所表示基團的前後方位在每一種化學式中都是一樣的,那么就可以直接對應寫出來。
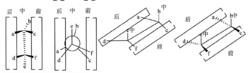 四個結構里的前、中、後(一)
四個結構里的前、中、後(一)實際在書寫的時候沒必要畫出前中後的位置,需要強調的是一個‘’左虛線-右粗線-下左-上右”的轉換方式,即位於費歇爾式左側的基團替換成楔形式時,實際所處的方位是下左方,遠離讀者用虛線表示;而位於費歇爾式右側的基團替換成楔形式時,實際所處的方位是上右方,面向讀者用粗線表示。如下圖的費歇爾式轉換成楔形透視式,先畫出由“下轉左一上轉右一寶蓋形”方式轉換成楔形式的共平面,再直觀地把左邊的基團面朝紙平面內,把右邊的基團面朝紙平面外即可。
 費歇爾式轉換成楔形透視式
費歇爾式轉換成楔形透視式但是對於下圖的交錯式構象,C-C的主鍵軸需要旋轉,但手性碳構型不會改變。也即方位法中一個手性碳原子C是一一對應,即為前後一致;另一個位於手性碳原子C卻恰好相反,為前對後,中對中,後對前。
 費歇爾投影式
費歇爾投影式當然直接轉化的費歇爾投影式往往是不規範的,運用書寫注意(4)的原理:若將其中一個費歇爾投影式的手性碳原子上的任意兩個原子或基團交換偶數次後,得到的投影式和另一投影式相同。通過調換兩次基團將-CH移動至最上方,即可將其轉化為規範的費歇爾投影式。
 調換兩次基團轉化為規範的費歇爾投影式
調換兩次基團轉化為規範的費歇爾投影式轉化為費歇爾投影式的好處是可以更直觀地判別R\S構型,具體方法請見判斷構型。下圖為其它三種化學式轉化成不規範費歇爾投影式,通過倒推法判斷出R\S構型的例子。
 三種化學式轉化成不規範費歇爾投影式
三種化學式轉化成不規範費歇爾投影式費歇爾式轉化成哈沃式
舉葡萄糖為例,費歇爾式中手性碳C*的右側羥基在哈沃式中處於含氧環的下方,左側羥基處在環面的上方。需要注意的是,C的氫原子原本應該在碳鏈的上方,但是由於成環形時,C必須繞C-C鍵發生旋轉,結果C的-CHOH旋至環面上方,C的氫原子到環面下面,而-OH則移至環平面形成氧橋。
環中的碳原子序號按順時針排列,即標準定位的哈沃式羥甲基在環平面上方的為D型糖,在環平面下方的為L型糖;不論是D型糖還是L型糖,異頭碳的羥基與末端的羥甲基是反式的是α異頭物,順式的則為β異頭物。
下圖為費歇爾投影式的鏈式結構向哈沃斯透視式的轉變成β-D-葡萄糖的動圖。
 費歇爾投影式向哈沃斯透視式的轉變過程
費歇爾投影式向哈沃斯透視式的轉變過程手勢法
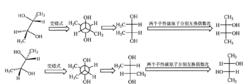
紐曼式轉化成費歇爾式
(1) 手性原子對應關係的確定
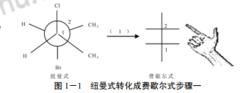 紐曼式轉換成費歇爾式步驟一
紐曼式轉換成費歇爾式步驟一根據紐曼投影式,畫出費歇爾式的框架,一般來說,紐曼式只有兩個手性碳原子,因此只需要畫出兩橫一豎的費歇爾式的骨架。
接下來既是確定兩個手性碳原子的對應關係,如紐曼式轉化成費歇爾式一為所示。紐曼式中的離眼近的倒“人”字型的碳原子標記為1,對應於費歇爾投影式中下面的手性原子;把紐曼式中的離眼遠的“人”字型的碳原子標記為2,對應費歇爾投影式中上面的手性原子。
(2) 確定費歇爾式中手性碳原子上所連的原子或原子基團
先確定費歇爾式中手性碳C上所連的原子或原子基團。紐曼式中碳C上連有H、Br、CH3和碳C。由於碳C已確定再下方,現主要確定H、Br、CH在費歇爾式中的位置。根據費歇爾式的書寫規則,要將分子的主碳鏈直立,並使命名編號小的碳原子處在上方。由此可知,甲基應放在費歇爾式中的豎鍵上。
為了明白H和Br的位置,我們伸開手掌面向自己去對應費希爾碳鏈骨架。使拇指與食指在水平方向且指向紙面前方,和費歇爾式的橫鍵相對應,即食指代表左側橫鍵,拇指代表右側橫鍵,手腕代表豎鍵。將手平移至紐曼式上,在紙面上逆時針或順時針轉動手腕與甲基對應,便使拇指、食指和手腕分別與碳原子C上的3個原子或原子基團對應。食指對應Br,而拇指對應H,因此在費歇爾式中左側橫鍵處寫Br,右側橫鍵處寫H。
同理,與碳 C相連的甲基應放在豎鍵上橫鍵上,可用相同方法確定剩餘的原子或原子基團的位置。食指對應H,而拇指對應Cl,所確定的費歇爾式如圖“紐曼式轉化成費歇爾式步驟四所示”。
費歇爾式轉化成紐曼式
(1) 畫出紐曼式的框架
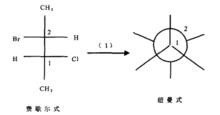 費歇爾式轉換成紐曼式步驟一
費歇爾式轉換成紐曼式步驟一根據費歇爾式畫出紐曼式框架,對應關係如前面所述。
把紐曼式中的離眼近的倒“人”字型的碳原子放在下方,標記為1;把紐曼式中的離眼遠的“人”字型的碳原子放在上方,標記為2,如右圖所示,紐曼式中朝向自己的手性原子和後面的手性原子分別對應於費歇爾投影式中下面的手性原子和上面的手性原子。
(2) 紐曼式中碳C中3個鍵所連基團的確定
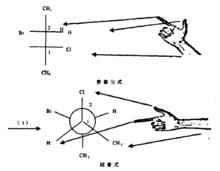 費歇爾式轉化成紐曼式三
費歇爾式轉化成紐曼式三需要注意的是,在費歇爾式中,手腕代表的是上方的甲基基團。將手平移至紐曼式上。
甲基在紐曼式通常放在下方,因此C2隻有兩個基團需要確定順序。需要注意的是,在費歇爾式中,手腕朝下。將手平移至紐曼式上,在紙面上逆時針或順時針轉動手腕,使拇指、食指和手腕分別與碳2 上的3個鍵重合。因此,Br在左邊,H在右邊。
由於費歇爾式是重疊式,因此在下端的甲基的左邊或者右邊,確定出碳C1的甲基,再通過拇指對應Cl,食指對應H,確定H在右邊,Cl在左邊。
鋸架式式轉化成費歇爾式
(1) 手 性原子對應關係的確定
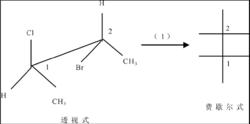 透視式轉化成費歇爾式
透視式轉化成費歇爾式鋸架式中朝向自己的手性原子對應於費歇爾式中下面的手性原子;鋸架式中後面的手性原子對應於費歇爾式中上面的手性原子。 同上,根據費歇爾式的書寫規則可知,甲基放在豎鍵上,如鋸架式轉化成費歇爾式步驟二。
(2) 費歇爾式中手性碳C上所連原子或原子基團的確定
將手平移至鋸架式上,在紙面上逆時針或順時針轉動手腕,使拇指、食指和手腕分別與碳2上的3個原子或原子基團重合。食指對應Br,而拇指對應H,就可以在費歇爾式中的左側橫鍵寫Br,右側橫鍵處寫H。
費歇爾式轉化成鋸架式
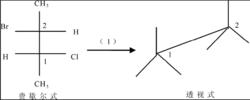 費歇爾式轉化成透視式
費歇爾式轉化成透視式根據費歇爾式畫出鋸架式框架,如圖費歇爾式轉化成鋸架式步驟一所示。鋸架式中碳C上3 個鍵所連基團的確定將手平移至鋸架式上,在紙面上逆時針或順時針轉動手腕,使拇指、食指和手腕分別與碳C上的3 個鍵重合。同理確定碳C,如費歇爾式轉化成鋸架式步驟三。
以上是通過手勢確定左右的基團的定位,優點是不必考慮是重疊式還是交叉式,對紐曼式、鋸架式中哪種構象都是適用的。
定理套用
例一
方位法雖然能夠直截了當找出基團的對應關係,但是如下圖例1,如果題目已經將要轉換的化學式的部分基團寫明,讓我們寫出餘下的對應的基團時,就需要一些技巧。
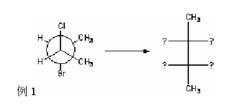 費歇爾投影式
費歇爾投影式解:為方便寫出費歇爾投影式,首先要把紐曼投影式中的兩個甲基旋轉到全重疊位置。注意此時兩個甲基寫在費歇爾投影式的豎線上,表面相對於觀察者來說即是“向後”,我們相當於站在在甲基的對面觀察,觀察位置如下圖中所示,最後把橫線上的基團一一對應標上。
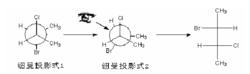 費歇爾投影式
費歇爾投影式例二
手勢法和方位法的本質都是一樣的,手勢法只是替換了解題中角度的旋轉顯得更加簡便,更重要的是對於碳C1和碳C2的對應關係的把握。如下圖已給出-OH和-Br,要求寫出餘下基團的排布。但如果直接使用手勢法就會錯誤,原因在紐曼式中圓圈代表碳2,人字代表碳1。但在費歇爾式中-OH基團與C相連,而Br與C相連,排布恰恰是相反的。
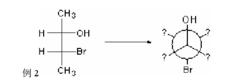 費歇爾投影式
費歇爾投影式出現這種費歇爾投影式十字架下方的碳對應紐曼投影式前碳不對應的情況,需要將費歇爾投影式在平面內轉動 180º,此過程中分子構型不會改變。再寫成紐曼投影式,然後轉動紐曼投影式前碳和後碳到題目要求的位置,或者使用手勢法用食指和拇指對應Br和-OH。
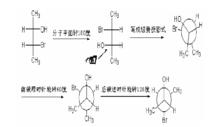 費歇爾投影式
費歇爾投影式費歇爾投影式和紐曼投影式互換規律:(1)費歇爾投影式十字架下方的碳對應紐曼投影式的前碳,費歇爾投影式十字架上方的碳對應紐曼投影式的後碳;(2)費歇爾投影式轉化為紐曼投影式時,先畫出全重疊構象,再分別旋轉前、後碳得到所需構型;(3)紐曼投影式轉化為費歇爾投影式時,先將紐曼投影式旋轉成全重疊構象,然後在 2,3 位碳間 σ 鍵的對面觀察,將其它基團一一對應標上。
例三
如在E2消除反應中消除氫原子,如下圖。但顯然,費歇爾投影式無法直接找到處於反式共平面的消除基團。
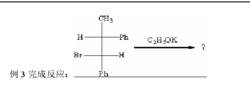 費歇爾投影式
費歇爾投影式此時可通過將費歇爾投影式轉換為鋸架式來解答。規律如下:(1)費歇爾投影式十字架下方的碳對應鋸架式下方的碳;(2)費歇爾投影式豎線上方的原子團在鋸架式中仍是背離觀察者的方向,這些原子團在鋸架式中相對於觀察者來說是向後;(3)在(1)(2)前提下,費歇爾投影式左邊的基團鋸架式中仍寫左邊,右邊基團鋸架式中仍寫右邊。 然後將氫原子和溴原子分別旋轉到正下方和正上方進行消除,具體過程如下圖。
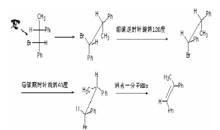 費歇爾投影式
費歇爾投影式