簡介
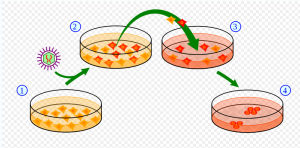 iPS細胞製作法
iPS細胞製作法誘導多能幹細胞是通過基因轉染技術,將某些轉錄因子導入動物或人的體細胞,使體細胞直接重構成為胚胎幹細胞,細胞樣的多潛能細胞。
誘導性多能幹細胞不僅在細胞形態、生長特性、幹細胞標專物表達等方面與ES細胞非常相僅,而且在DNA甲基化方式、基因表達譜、染色質狀態、形成嵌合體動物等方面也與ES細胞幾乎完全相同。
研究歷程
iPS細胞2006年日本京都大學山中伸彌(ShinyaYamanaka)領導的實驗室在世界著名學術雜誌《細胞》上率先報導了iPS的研究。
他們把Oct3/4、Sox2、c-Myc和Klf4這四種轉錄因子引入小鼠胚胎或皮膚纖維母細胞,發現可誘導其發生轉化,產生的iPS細胞在形態、基因和蛋白表達、表觀遺傳修飾狀態、細胞倍增能力、類胚體和畸形瘤生成能力、分化能力等都與胚胎幹細胞極為相似。
2007年11月,由中國科學家俞君英領銜的Thompson實驗室和山中伸彌實驗室幾乎同時報導,利用ips技術同樣可以誘導人皮膚纖維母細胞成為幾乎與胚胎幹細胞完全一樣的多能幹細胞。
所不同的是日本實驗室依然採用了用逆轉錄病毒引入Oct3/4、Sox2、c-Myc和Klf4四種因子組合,而Thompson實驗室採用了以慢病毒載體引入Oct4、Sox2加Nanog和LIN28這種因子組合。
這些研究成果被美國《科學》雜誌列為2007年十大科技突破中的第二位。
2008年,哈佛大學GeorgeDaley實驗室利用誘導細胞重新編程技術把采自10種不同遺傳病患者病人的皮膚細胞轉變為iPS,這些細胞將會在建產疾病模型、藥物篩選等方面發揮重要作用。
美國科學家還發現,iPS細胞可在適當誘導條件下定向分化,如變成血細胞,再用於治療疾病。
哈佛大學另一家實驗室則發現利用病毒將三種在細胞發育過程中起重要作用的轉錄因子引入小鼠胰腺外分泌細胞,可以直接使其轉變成與幹細胞極為相似的細胞,並且可以分泌胰島素、有效降低血糖。這表明利用誘導重新編程技術可以直接獲得某一特定組織細胞,而不必先經過iPS細胞這一步。
2009年,中國科學家於2008年11月利用iPS細胞培育出小鼠—“小小”。
中國科學院動物研究所周琪研究員和上海交通大學醫學院曾凡一研究員領導的研究組合作完成的工作表明,利用iPS細胞能夠得到成活的具有繁殖能力的小鼠,從而在世界上第一次證明了iPS細胞與胚胎幹細胞具有相似的多能性。科學家表示,這一研究成果表明iPS細胞或許同胚胎幹細胞一樣可以作為治療各種疾病的潛在來源。
建立過程iPS細胞建立的過程主要包括:
(1)分離和培養宿主細胞;
(2)通過病毒介導或者其他的方式將若干多個多能性相關的基因導入宿主細胞;
(3)將病毒感染後的細胞種植於飼養層細胞上,並於ES細胞專用培養體系中培養,同時在培養中根據需要加入相應的小分子物質以促進重編程;
(4)出現ES樣克隆後進行iPS細胞的鑑定(細胞形態、表觀遺傳學、體外分化潛能等方面)。
iPS細胞的出現,在幹細胞研究領域、表觀遺傳學研究領域以及生物醫學研究領域都引起了強烈的反響,這不僅是因為它在基礎研究方面的重要性,更是因為它為人們帶來的光明的套用前景。在基礎研究方面,它的出現,已經讓人們對多能性的調控機制有了突破性的新認識。細胞重編程是一個複雜的過程,除了受細胞內因子調控外,還受到細胞外信號通路的調控。對於Oct4、Sox2和Nanog等維持幹細胞自我新能力的轉錄因子的研究正在逐漸地展開;利用iPS細胞作為實驗模型,只操縱幾個因子的表達,這更會大大加速對多能性調控機理的深入研究。在實際套用方面,iPS細胞的獲得方法相對簡單和穩定,不需要使用卵細胞或者胚胎。這在技術上和倫理上都比其他方法更有優勢,iPS細胞的建立進一步拉近了幹細胞和臨床疾病治療的距離,iPS細胞在細胞替代性治療以及發病機理的研究、新藥篩選方面具有巨大的潛在價值。此外,iPS細胞在神經系統疾病、心血管疾病等方面的作用也日益呈現,iPS細胞在體外已成功地被分化為神經元細胞、神經膠質細胞、心血管細胞和原始生殖細胞等。在臨床疾病治療中具有巨大套用價值。2019年02月27日,據英國《自然》雜誌網站近日報導,日本衛生部的一個委員會首次批准“重新編程”幹細胞用於臨床治療脊髓損傷,這一準入意味著誘導多能幹細胞(iPS)治療脊髓損傷的臨床試驗將於今年年底進行。iPS細胞通過誘導來自身體組織的細胞恢復到類似胚胎的狀態而生成,這種細胞可以發育成其他細胞類型。
成果發布
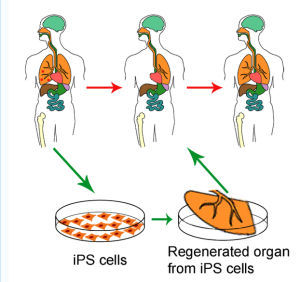 利用再生醫學手段,將受損之肺臟以iPS細胞所形成之臟器組織進行再生
利用再生醫學手段,將受損之肺臟以iPS細胞所形成之臟器組織進行再生研究方法
iPS細胞是由一些多能遺傳基因導入皮膚等細胞中製造而成。在製造過程中,研究人員使用了4種遺傳基因,同時加入了7種包括可阻礙特定蛋白質合成的物質和酶在內的化合物,以研究其各自的製造效率。研究結果顯示,沒有添加化合物時,遺傳基因的導入效率為0.01%-0.05%,而加入了一種叫“巴爾普羅酸”的蛋白質合成阻礙劑之後,導入效率竟升至9.6%-14%。如果從這4種遺傳基因中排除導致細胞癌化的遺傳基因,只使用3種基因,過去的導入效率只有0.001%甚至更低,而加入“巴爾普羅酸”之後,其效率也提高了約50倍。研究人員認為,這很可能是因為“巴爾普羅酸”可以促進多能遺傳基因的活性。今後,研究人員將就添加化合物是否會使遺傳基因產生變異展開研究,以在提高製造效率的同時保證安全性。
面臨困難
這些研究人員警告說,用誘導性多能幹細胞治療人類疾病仍然需要克服許多關鍵障礙。比如,添加4個“重新編程”基因或取代疾病細胞中有缺陷基因的方法都可能有導致癌症的副作用。在誘導性多能幹細胞能被考慮用於人類療法之前,研究人員需要發展出安全的方法來解決這些以及其他可能的問題。優缺點
優點
與經典的胚胎幹細胞技術和體細胞核移植技術不同,iPS技術不使用胚胎細胞或卵細胞,因此沒有倫理學的問題。利有iPS技術可以用病人自己的體細胞製備專有的幹細胞,所以不會有免疫排斥的問題。
缺點
比如,添加四個“重新編程”基因或取代疾病細胞中有缺陷基因的方法都可能有導致癌症的副作用。套用領域
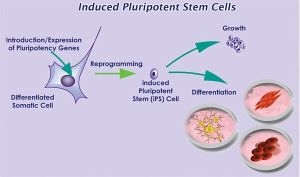 iPS細胞原理:全程可在實驗室完成
iPS細胞原理:全程可在實驗室完成 安全性
日本科學家利用重編程小鼠幹細胞生成了皮膚和骨髓,並將它們移植到基因相同的小鼠體內,結果發現這並不會引發強烈的免疫反應。對免疫反應的恐懼可能被高估了。應該可以讓那些指望利用誘導多能幹細胞(iPSCs)來治療疾病的研究人員消除疑慮。2011年,同樣發表在Nature雜誌上的一項研究發現:iPSCs可能會遭受免疫系統排斥,即便是將細胞注入供體自身體內時。免疫反應有可能會破壞移植物,導致治療無效。這使得科學界對於iPSCs實驗性治療的前景產生了質疑。兩項相互矛盾的研究之間存在的技術差異,使得人們很難估計iPSCs是否真的可以避免免疫攻擊。但未參與兩項研究的加州大學戴維斯分校的細胞生物學家PaulKnoepfler認為,新研究結果是“非常令人鼓舞的。它們強有力地表明,未來將人類iPSC治療會輸給同一患者,或許不會引發臨床顯著的免疫反應。”研究結果是令人充滿希望的,但Abe生成嵌合子小鼠的技術,以及將它們作為供體的做法,遭到了其他研究人員的質疑。徐洋說這種方法是“有缺陷的”——早在將iPSCs移植到其他小鼠體內之前,嵌合子小鼠的免疫系統就已經對來源於iPSCs的問題細胞產生了排斥或耐受。這或許可以解釋為何這些移植會如此成功,而在臨床上這卻並非是一種可行的方法。與之相反,人類的iPSCs是在實驗室培養物中分化為更特化的細胞得。展望
由於iPS細胞自身的安全性問題,到2012為止,iPS細胞還無法套用於臨床治療,要得到安全實用的有臨床套用價值的治療型iPS細胞,必須避免使用整合性病毒以及有致癌性的外源基因。根據iPS細胞在短時間內取得的一系列突破,可以預見,iPS細胞必將解決人類面臨的各種疾患。但是還面臨許多急待突破瓶頸和需要深入研究的領域:
(1)研究iPS細胞自我複製、增殖和分化等的調控機制及iPS細胞體外定向誘導分化機制;(2)充分評價iPS細胞臨床套用的安全性;(3)建立無遺傳修飾的iPS細胞製備方法(如僅利用蛋白或小分子化合物即將人的細胞重編程為iPS細胞)。用iPS細胞復活“日本朱䴉”首先,利用病毒媒介將可以初始化細胞的四個基因,分別導入在冷凍箱中保存的日本朱䴉的成纖維細胞中,培育出iPS細胞。再將iPS細胞移植到人工繁殖得到的日本外的朱䴉的胚胎(反覆分裂的受精卵)中。這樣,由日本朱䴉的iPS細胞,與日本外朱䴉的受精卵混雜在一起,就產生了一個新個體(雜交朱䴉)。使雜交朱䴉之間相互交配,就可以使日本朱䴉的iPS細胞產生生殖細胞相互交配並產生個體,也就可以使日本朱䴉復活了。新方法
研究人員用來產生誘導性多能幹細胞(inducedpluripotentstemcells,iPSCs)的方法既花時間而且效率又低。按照當前的方法,當把四種轉錄因子導入成體細胞如皮膚細胞中時,利用上千個皮膚細胞最終只能獲得幾個iPSCs。為此,在這項新的研究中,來自美國桑福德-伯納姆醫學研究所(Sanford-BurnhamMedicalResearchInstitute)的研究人員尋求激酶抑制劑的幫助,其中這些抑制劑阻斷激酶---一類在細胞通信、存活和生長等方面發揮著重要作用的酶---的活性。他們發現幾個激酶抑制劑當加入到起始細胞(如皮膚細胞)時,有助於產生比標準方法還要多的iPSCs。這些發現將可能加快很多領域的研究,和更好地能夠讓全世界的科學家們研究人類疾病和開發出新的治療方法。相關研究結果於9月25日刊登在NatureCommunications期刊上。
論文通信作者TariqRana博士解釋道,“獲得iPSCs依賴於調節細胞內的通信網路。因此,當開始操作細胞中哪些基因開啟或關閉來產生多能性幹細胞時,人們很可能激活了許多激酶。因為許多活性的激酶可能抑制iPSCs產生,所以對我們而言,加入激酶抑制劑來降低這種障礙可能就有意義。”根據未參與這項研究的沙克生物研究所(SalkInstituteforBiologicalStudies)癌症中心主任TonyHunter博士的說法,鑑定出改善產生iPSCs效率的小分子為在治療上能夠使用這些細胞邁出重要的一步,而且TariqRana的這項新研究發現了一類蛋白激酶抑制劑能夠有效地促進iPSCs形成,因此這些抑制劑在產生用於實驗研究和治療目的的iPSCs中應當是非常有用的。在這項研究中,Rana實驗室研究生ZhonghanLi著手尋找可能加快產生iPSCs過程的激酶抑制劑。利用斯坦福-伯納姆醫學研究所康拉德-普利貝斯化學基因組中心(ConradPrebysCenterforChemicalGenomics)提供的240多種抑制激酶的化合物,Li費力地將它們一個接一個地加入到他培養的細胞中然後等待觀察會有什麼發生。幾種激酶抑制劑產生更加多的iPSCs,在某些情形下,對於培養它們的小盤子而言,能夠產生太多的iPSCs。特別地,最為強效的抑制劑靶向三種激酶:AurkA、P38和IP3K。在其他同事的幫助下,Rana和Li還證實了這些發現的特異性,甚至確定了一種抑制劑發揮有益作用背後的機制。Rana說,“我們發現操縱這些激酶的活性能夠顯著性地增加細胞重編程效率。不過,更重要的是,我們也對重編程的分子機制提供了新的深入認識,並且揭示出這些激酶的新功能。我們希望這些發現將促進人們進一步篩選可能在iPSC療法中有用的小分子。”人體實驗
據英國《自然》雜誌網站2014年9月11日報導,治療使用的iPS細胞由日本神戶理化研究所(RIKEN)發育生物學中心的眼科專家高橋雅代培育而成,將用於治療與年齡相關的視網膜退化疾病。罹患這一疾病的病患,多餘的血管會在眼內形成,讓視網膜色素上皮細胞變得不穩定,導致感光器不斷減少,最終失明。一名罹患退行性眼病的日本患者成為全球使用誘導多能幹細胞(iPS)進行治療的第一人。
2017年3月30日,日媒報導,日本理化學研究所等團隊日前實施手術,將他人的iPS細胞(人工多功能性幹細胞)轉換為視網膜細胞後,移植入可能面臨失明的視網膜病變患者體內。此次在臨床手術中利用他人iPS細胞屬世界首例。據悉,與使用患者自身的細胞相比,使用他人iPS細胞的情況可大幅減少準備費用及時間,將更接近多數患者能夠接受的醫療方式。
科學醜聞
一、2012年10月就iPS幹細胞(誘導多能幹細胞)製作心肌細胞移植給重症心臟病患者的研究成果屬於虛構一事,東京大學醫院的特任研究員森口尚史自己承認了造假的事實。
二、日報京都大學一個調查學術不端行為的委員會2018年1月22日公布的調查結果認定,以CiRA特聘助理教授山水康平為第一作者的研究小組,在2017年3月14日發表於美國《幹細胞報告》雜誌網路版上的一篇論文中,多處捏造和篡改數據,論文中6個主要數據全部造假,而6個補充數據中有5個造假。京都大學官網22日發布公告稱,該大學iPS細胞研究與套用中心(CiRA)研究人員去年3月發表的一篇論文存在造假行為,CiRA負責人、諾貝爾獎得主山中伸彌為此召開記者會致歉。
人體幹細胞
| 成體幹細胞;神經幹細胞;造血幹細胞;角膜緣幹細胞;胚胎幹細胞;臍帶血幹細胞;雌性生殖幹細胞;多能幹細胞;豬萬能幹細胞;全能幹細胞;精原幹細胞;腫瘤幹細胞;毛玻璃樣幹細胞;蘋果乾細胞;胚胎幹細胞;癌幹細胞;間充質幹細胞;肌肉干細胞;骨髓造血幹細胞;紅細胞樣幹細胞;誘導性多能幹細胞;球蛋白 |