 葉綠體基因組結構
葉綠體基因組結構簡介
 葉綠體
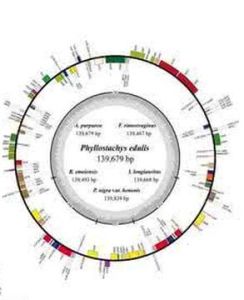
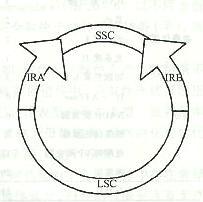
葉綠體葉綠體基因組中的基因數目多於線粒體基因組,編碼蛋白質合成所需的各種tRNA和rRNA以及大約50多種蛋白質,其中包括RNA聚合酶、核糖體蛋白質、核酮糖1,5—二磷酸核酮糖羥化酶(RuBP酶)的大亞基等。高等植物的葉綠體基因組的長度各異,但均有10~24kb的一段DNA序列的兩份拷貝,互呈反向重複序列(1RA和IRB)。這兩份反向重複序列之間發生重組,形成了一份短的單拷貝序列(short single copy,SSC),把IRA和IRB連線起來,基因組的其餘部分則是長的單拷貝序列(long single copy,LSC)。葉綠體基因組同線粒體基因組一樣,都是細胞里相對獨立的一個遺傳系統。葉綠體基因組可以自主地進行複製,但同時需要細胞核遺傳系統提供遺傳信息。例如,光合系統Ⅱ中的chla/b蛋白質是在細胞質內的80S核糖體上合成後再轉運進葉綠體的;RuBP酶的大亞基是在葉綠體內合成的,但其小亞基則是在細胞質中80s核糖體上合成後轉運進葉綠體,然後同大亞基裝配成有生物學活性的全酶。
cpDNA
 葉綠體基因組代謝控機制簡圖
葉綠體基因組代謝控機制簡圖每個葉綠體中cpDNA的拷貝數隨著物種的不同而不同。但都是多拷貝的。這些拷貝位於類核區。例如甜菜的葉細胞中每個類核體有4~8個拷貝的cpDNA,而每個葉綠體有4~18個類核體,每個細胞中約有40葉綠體。每個細胞總共有約6000cpDNA分子。在衣藻中(chlamydomonas)(單細胞生物)在細胞中一個葉綠體含有500~1500 cpDNA分子。
菸草和水稻(Oryza sativa)葉綠體全序列分析表明cpDNA基因組成有以下特點:
1.基因組由兩個反向重複序列(IR)和一個短單拷貝序列(short single copy seguence, SSC)及一個長單拷貝序列(long single copy seguence, LSC)組成;
2.IRA和IRB長各10-24Kb,編碼相同,方向相反。
3.cpDNA啟動子和原核生物的相似,有的基因產生單順反子的mRNA,有的為多順反子mRNA;
4.儘管cpDNA大小各不相同,但基因組成是相似的,而且所有基因的數目幾乎是相同的,它們大部分產物是類囊體的成分或和氧化還原反應有關(表20-7);
5.其tRNA基因(IRA、IRB上各有7個,LSC上有23個,共37個)中有內合子存在,最長者達2526bp,此和原核tRNA不同。有的內合子位於D環上,此和原核tRNA不同。有的內含子位於D環上,此和真核生物核tRNA內含子常位於反密碼子環上也不相同;
6.所有葉綠體基因轉錄的mRNA都由葉綠體核糖體翻譯。
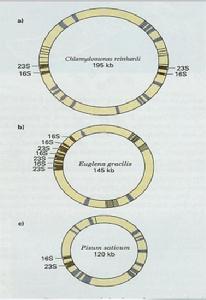
並不是所有的葉綠體都含有IR,IR上含有4種rRNA基因,根據它們排列的情況葉綠體可分為3類:I類是IR 序列,4種rRNA各有2個拷貝,對稱分布在IR上cpDNA也較大,如玉米、菸草、水稻、菠菜、地錢、衣藻(C.Yreinhardi),大部分葉綠體都屬此類。II類:無反向重複IR,而在cpDNA一側16S,23S以正向串聯重複的形式(各3個拷貝)排列。如少數低等植物,裸藻(Euglena gracilis);III類:無IR和DR,rRNA只有一拷貝,如豌豆(Posum satirum)等。這可能在進化的過程中DNA片段的重複和倒位而造成的。
相關研究
 葉綠體基因組
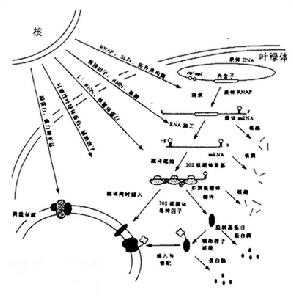
葉綠體基因組葉綠體基因組的特點是具相同或相關功能的基因組成複合操縱子結構。這一特點有利於葉綠體基因的表達與調控,例如rpoB-rpoC-rpoC 2操縱子是由編碼RNA聚合酶各個亞基的基因聚合在一起而形成的,而psbI-psbK-psbD-psbC操縱子則編碼PSⅡ的部分蛋白質。葉綠體基因組基因表達調控方式。
轉錄水平調節。轉錄後調節與修飾。萊茵衣藻核基因組與葉綠體基因組遺傳轉化體系的建立,以及許多光合途徑缺陷突變體的分離為研究轉錄後調節提供了一個非常有用的模式系統。遺傳分析表明RNA加工和RNA編輯為影響葉綠體基因表達轉錄後調節的因素。翻譯水平調節。翻譯水平調節可使生物快速地適應外界環境條件,特別對於高效表達基因,當環境條件不利時,可通過翻譯水平快速調節,從而減少代謝能源的消耗。RNA水平和細胞器代謝狀態影響葉綠體蛋白的翻譯, 這種調節可能是通過核糖體蛋白反式磷酸化來完成的。翻譯後調節與修飾。對於質體編碼的葉綠素。
在每個葉原基細胞增殖過程中,位置信息決定細胞命運,因而不同細胞如葉肉細胞、皮層細胞、保衛細胞中對葉綠體的發育進行微調,大多數是通過調節RNA穩定性、剪接、翻譯以及蛋白質穩定性來實現的,並顯示核基因可以控制那些核和質體共同編碼的、最終裝配為複合體的蛋白基因。當發育為葉片時,不同細胞類型的核基因表達有所不同,不同細胞的位置信息,通過不同的基因調節機制,引起質體和核基因的細胞特異表達。最後,葉片細胞以關掉編碼葉綠體蛋白的基因和核基因表達而進入衰老階段。
基因表達調控是由一系列複雜的調控機制組成的。不同的調節機制在一定條件下對特定基因起調節作用,不同的調節策略可使不同植物來適應各自的生存條件,如:光、溫、水和營養條件可調節植物的代謝活動。除上面提到的環境因素外,還涉及葉綠體基因轉錄及轉錄後調節、翻譯與翻譯後修飾調節、核基因對葉綠體基因在轉錄與翻譯過程中的調節和質體產生的信號對核編碼的質體蛋白的表達調節等等。因此,很難對葉綠體基因表達找出一個固定模式。在未來的研究中,核基因組和質體基因組如何在質體發育過程中起到相互調節作用將會成為一個最可能出成果的研究領域。
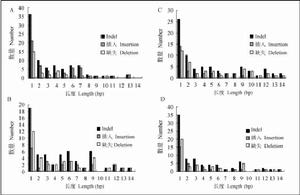 4種茄科植物葉綠體基因組中indels長度分布圖
4種茄科植物葉綠體基因組中indels長度分布圖原核的藍藻和真核植物(包括其他藻類)中的葉綠體,都同樣進行放氧的光合作用,這為人類和整個生物界提供了賴以生存的食物、氧氣、能源和原料。對葉綠體和藍藻的細胞結構和分子生物學特性作分析,證明真核生物的葉綠體可能起源於藍藻祖先的內共生。這使藍藻在20多年來已成為光合作用研究的模式生物。
藍藻基因組的作圖和測序由日本Kazusa DNA研究所以S.Tabata博士領導的研究組,於1994年開始對集胞藻(Synechocystis sp. PCC6803)作分析,已於1996年完成。最近他們又基本完成了對魚腥藻(Anabaena sp. PCC7120)的全序列測定。集胞藻6803的基因組大小為3,573,470bp,含有3168個編碼蛋白的潛在基因,占全基因組87%。它的基因密度為1.1kb/基因,一個基因表達的產物平均長度為326個胺基酸殘基,這些都是細菌基因組的典型數據。在3168個潛在基因中,1416個基因(45%)與已知的相似,尚有1752個基因(55%)需要鑑定。1416個已知基因中,按生物學功能可分成15類,其中與光合和呼吸有關的有131個,與轉錄有關的為24個,與翻譯有關的144個。
把10種葉綠體的光合器蛋白和光合代謝中蛋白與藍藻比較同一性發現,進化上差異越大,它們的同一性越差;在不同基因的同一性也有不同,如編碼光合器的同一性較高,編碼光合代謝的基因同一性差些。在編碼光合器的蛋白中,光系統I和II反應中心的蛋白同一性較好。現在要做的是如何解釋從藍藻進化到葉綠體失去了絕大部分基因及為何在葉綠體進化中保留下來的蛋白在同一性上有這樣的差異,從這些差異上能否得到啟示來改造基因來提高光合作用效率。