 腎澱粉樣變性
腎澱粉樣變性流行病學
 前體蛋白結構圖
前體蛋白結構圖病因:
學者們對病變組織中的沉積物進行了細緻的化學分析與研究,發現所有澱粉樣沉積物中85%~95%為纖維成分,該纖維成分即為澱粉樣物質的前體蛋白,可溶於水和低離子強度的緩衝液,分子量介於4000~25000Da。迄今已鑑定出20餘種澱粉樣物質的前體蛋白,這些蛋白質的一級結構各不相同,既可以以溶解的形式也可以以纖維的形式存在。以纖維形式存在時,X線衍射可以見到這些澱粉樣纖維具有共同的核心結構,即與澱粉樣纖維長軸垂直的反平行β片層樣結構,因此,也有些學者認為澱粉樣變性是一種蛋白質二級結構病。研究還發現,明確這些蛋白質不僅具有病因學意義與臨床表現相關疾病治療與預後也有直接的關係因此建議臨床醫生在確立澱粉樣變性的診斷以後,要進一步分析澱粉樣沉積物質的化學組成。以下簡要介紹幾種主要的澱粉樣變前體蛋白。
發病機制
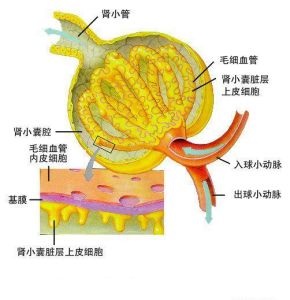 腎小球結構圖
腎小球結構圖2.在繼發性澱粉樣變性病和家族性地中海熱,部分在急性期合成增加的血清AA阿朴脂蛋白可作為AA澱粉樣物質沉積;在β2-M引起的澱粉樣變性病β2-M的血清水平增加,是由於產生過多或分泌或降解減少所致但沉積與血清水平無關,而有人認為β2-M的血清水平增加足以在組織中積累引起澱粉樣變。長程血透患者Aβ2-M沉積的可能發病機制如下:
(1)尿毒症血透患者的腎功能喪失,腎小球濾出的β2-M減少血β2-M蓄積升高。長期套用一般透析器作血液透析者,因銅仿膜及纖維素膜對β2-M清除極少。如換用PAN膜、聚碸膜或碳酸甲脂膜透析器,因對流清除Aβ2-M蓄量增加,且膜表面對β2-M的吸附增加,可使Aβ2-M清除增加,使血中β2-M水平降低。
(2)透析液內毒素污染及透析膜作用可激活單核巨噬細胞及淋巴細胞,致使細胞因子如白介素-1(IL-1)、腫瘤壞死因子(TNF)及轉化生長因子(TGF)產生增加,並釋放入骨基質和軟骨中,促使Aβ2-M在骨沉積而致病。它們促進骨質吸收作用比甲狀旁腺激素更大。
3.在一些澱粉樣蛋白,尤其是ASC蛋白或AE蛋白,由於單個胺基酸的替代,使得沉積蛋白不同於正常的相似物,因此認為沉積可能直接與由於肽順序的改變而引起的分子生化特性變化有關。在AL型澱粉樣變,沉積的輕鏈常是原輕鏈的水解片段偶爾為原輕鏈。
4.由於澱粉樣沉積的可能媒介的部分突變和分解,在β2-M沉積中所涉及的蛋白質比正常的β2-M更偏酸性和高級糖基化的特徵,糖基化β2-M可引起TNF-α、IL-1和單核細胞趨化呈短暫性升高
5.確實所有的澱粉樣蛋白常與氨基多糖和澱粉樣P物質(即SAP蛋白)一起沉積澱粉樣蛋白沉積的分子機制仍在研究中。
臨床表現
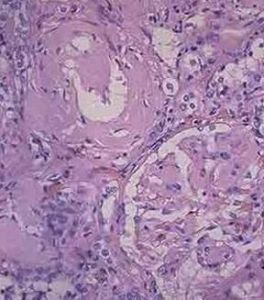
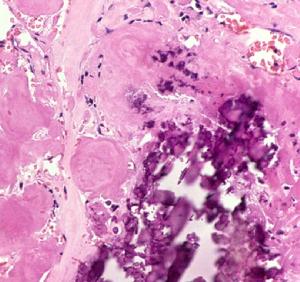 腎澱粉樣變性病理圖
腎澱粉樣變性病理圖1.分型 澱粉樣變有幾種類型每一種可通過澱粉樣蛋白纖維的免疫化學性質來區分。這些基本的特徵是:在X線衍射檢查的β片層結構;電子顯微鏡下的細纖維非分枝表現;在剛果紅染色後,在偏光顯微鏡下的蘋果綠雙折射。根據這些生化特點,結合病理特徵及臨床表現分為6型。
(1)AL型(即原發性澱粉樣變性病):原發性澱粉樣變性病是指病因不明、無存在其他疾患而發生的澱粉樣變性病,主要侵犯心臟消化道舌、皮膚和神經系統,腎受累者占40%。
(2)AA型(即繼發性澱粉樣變性病):繼發性澱粉樣變性病是指在其他疾病過程中發生的。
併發症
澱粉樣變性病為一種全身性疾患,除有腎臟受累外,尚有其他臟器受累;腎臟受累由腎病綜合徵發展到尿毒症需1~3年不等,常見併發症為腎靜脈血栓。腎小球的澱粉樣沉積的程度與腎功能的相關性很差。
鑑別診斷:
1.AL型澱粉樣變性病與多發性骨髓瘤 AL型澱粉樣變性的骨髓檢查常表現為漿細胞計數增加,且兩者的澱粉樣蛋白均為AL型,使其一時很難與多發性骨髓瘤鑑別。如果骨髓漿細胞數少於25%,血或尿中存在少量單克隆蛋白無相關的貧血、高鈣血症和溶骨性損害則AL型澱粉樣變性的可能性更大。
2.AA型型澱粉樣變性病與其各病因之間要注意鑑別。
檢查
1.尿液檢查 可見尿蛋白,尿中出現M蛋白的患者同時出現大量蛋白尿,而尿檢查發現單克隆異常蛋白的陽性率可到86%,偶見鏡下血尿,尿沉渣有顆粒或脂肪管型。
2.血液生化檢查 可見纖維蛋白原減少、纖溶亢進及凝血因子缺乏外周血發現Howell-Jolly小體,提示脾臟受累。重者可見肝功異常,出現黃疸少見
3.約2/3患者的血清電泳或免疫電泳可發現單克隆的異常蛋白,免疫電泳和免疫固定有時用來測定血或尿中的微量蛋白。免疫球蛋白濃度測定有助於多發性骨髓瘤的分型診斷,患者尿中有本-周蛋白,能與κ鏈和λ鏈的抗血清起反應,而不能與任何一種免疫球蛋白的重鏈起反應。
4.測定血中SAA蛋白水平,AA蛋白由其前身SAA蛋白演變而來,血中SAA濃度升高提示為AA蛋白所致繼發性澱粉樣變性在類風濕關節炎、潰瘍性結腸炎、結核、腫瘤,及慢性感染急性期時,SAA均升高且同時伴C-反應蛋白升高,故SAA高低可用以區別感染是否活動期,SAA>0.2μg/ml見於活動炎症,感染控制後SAA水平降低長程透析患者有骨病表現時,血中β2-M異常升高可助澱粉樣變性的骨病診斷。
治療
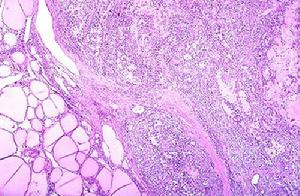 腎澱粉樣變性病理圖
腎澱粉樣變性病理圖2.特殊治療
(1)AL蛋白相關澱粉樣變:治療AL澱粉樣變的關鍵在於抑制單克隆漿細胞的增殖,從而抑制免疫球蛋白輕鏈的產生。前瞻性研究結果顯示套用潑尼松(強的松) 0.8mg/(kg?d)+氧芬胂(馬法蘭) 0.15mg/(kg?d),連續7天,每6周1次,可使約1/3有腎病綜合徵的患者尿蛋白減少或消失,且多數患者腎功能穩定。也有研究表明氧芬胂(馬法蘭)+潑尼松(強的松)聯合治療療效優於單獨使用氧芬胂(馬法蘭)、潑尼松(強的松)或秋水仙鹼,使患者存活期延長。長期使用氧芬胂(馬法蘭)要注意有誘發白血病和骨髓異常增生的可能。也可參照多發性骨髓瘤的其他化療方案如採用長春新鹼、多柔比星(阿黴素)地塞米松等已證實單獨使用腎上腺皮質激素治療腎澱粉樣變性無效,但如果合併有急性新月體腎炎則可考慮予以皮質激素衝擊治療。另外,如有腎上腺受累後功能低下者也為使用糖皮質激素的適應證。
預後
與其他腎小球疾病比較,腎澱粉樣變性預後不良,生存期與原發病以及重要器官受累的範圍和程度有關。原發性AL蛋白所致者的中位數存活期為1~2年,標準美法侖加激素治療可延長生存期10個月但腎臟、心臟功能恢復困難。對841例原發性澱粉樣變患者的長期隨訪表明,1年生存率51%,5年為21%10年只有4.7%。其存活期縮短與氮質血症的存在有強相關性。最長存活期AL型者為22年AA型者為18年。AL蛋白所致者,心力衰竭、心律失常、猝死為其主要原因,占63%;繼發性AA蛋白所致者平均存活期為45個月,存活5年以上者僅為6%,多死於腎衰竭,占35%。
預防:
腎澱粉樣變性的預防應以積極治療能誘發腎澱粉樣變性的原發疾病為主。伴結核膿胸者已少見,說明預防為有效的措施局限型有時可手術切除;AL伴骨髓瘤者用烷化劑和潑尼松治療50%~60%可緩解,原發性AL亦可試以上述治療或同時用二甲亞碸(dimethyl sulfoxide)及烷化劑。秋水仙鹼對家族性地中海熱引起的AA澱粉樣變有積極預防的作用,但對其他ALAA治療效果不一致支持療法有助於延長存活期,包括合理使用利尿劑可改善心腎功能,抗生素使用可改善因感染所致的後果等。