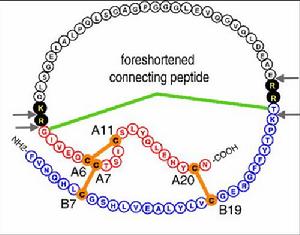
 胰島素原一級結構胺基酸組成
胰島素原一級結構胺基酸組成基本性質: β細胞初始分泌的未成熟胰島素,是一條86個胺基酸組成的長肽鏈,簡稱胰島素原,在高爾基體中經過前激素轉化酶(prohormone convertase, PC)切除得到胰島素及C肽,分泌進入血液循環。胰島素原是胰島素的 前體,1960年發現了胰島素原,其分子量約為9000,含有86個胺基酸,是一 單鏈多肽,它由一條連線肽(簡稱C肽)的一端通過兩個鹼性胺基酸殘基與胰島 素A鏈的N末端相連,C肽的另一端通過另兩個鹼性胺基酸殘基和B鏈的C末端相連。不同種屬動物的C肽不同,例如人的C肽為31肽,豬的C肽為29 肽,牛的C肽為26肽。(右圖所示)
來源: 胰島素本身並不是胰島素基因控制合成的直接產物,其直接產物是前胰島素原(preproinsulin)。它由NH2 -末端信號序列(稱為信號肽),B鏈、C肽(又叫連線肽,connecting piptide)和具COOH-末端的A鏈等部分組成的單鏈由N端至C端的連線順序為S-B-ARG-Arg-C-Lys-Arg-A,其中S為信號肽,C代表C-肽,由35個胺基酸殘基組成,A和B分別為胰島素的A鏈和B鏈。全長119個胺基酸殘基。信號肽由24個胺基酸殘基組成,富含疏水胺基酸。在 信號肽的作用下,正在合成的肽鏈進入內質網腔,經過信號肽酶的切割作用,移去信號肽,形成胰島素原。胰島素原分子發生摺疊,使其2個末斷片段A和B之間形成正確的二硫鍵,並最終包裝成分泌顆粒的形式儲藏在高爾基體中。當機體需要時,高爾基體中的轉換酶(convertase)PC3和PC2——一類與枯草蛋白酶相關的內切蛋白酶——便會分別對胰島素原分子中的B/C和C/A連線點發生切割作用,再在羧肽酶的作用下的分別切去Arg-Arg和Arg-Lys鹼性二肽,從而移走了一段長度為31個胺基酸的C肽,成為成熟的胰島素。(右圖所示)
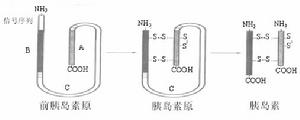 前胰島素原轉化為胰島素過程
前胰島素原轉化為胰島素過程功能:胰島素原的生物學作用同胰島素基本一樣,只是活性較弱,生物合成的胰島素原在外周利用葡萄糖的能力只有胰島素的5%一10%,但它抑制肝臟釋放葡萄糖的能力則為利用外周葡萄糖能力的1.5倍。儘管胰島素原的生物活性較弱,但它的降糖作用較胰島素持久,這可能是由於胰島素原具有較長的半衰期的緣故。
<0.2μg/L 或<0.3IRI總量
增加:胰島素瘤,變異胰島素血症。
