名詞定義
中文名稱:競爭性抑制劑
英文名稱:competitiveinhibitor
定義:能夠產生競爭性抑制作用的抑制劑。一般在結構上與被抑制酶的底物相似,只能與游離酶結合,不能與酶-底物複合物結合。能與底物競爭酶的活性部位,形成可逆的酶-抑制劑複合物,但酶-抑制劑複合物不能分解成產物,酶反應速度因此下降。
簡介
產生競爭性抑制作用的抑制劑。如果抑制劑濃度恆定,則在低底物濃度([s])時抑制作用最為明顯,增大[s],抑制作用隨之降低,直到[s]增大至很濃時,抑制作用近於消失,達到未加抑制劑時的最大反應速度(Vmax)水平,其動力學特徵是:表觀反應常數(Km)增大、Vmax不變。抑制程度只與抑制劑濃度有關。典型的例子如丙二酸和草醯乙酸對琥珀酸脫氫酶的抑制;磺胺藥與對氨基苯甲酸(合成二氫葉酸的原料)抑制細菌二氫葉酸合成酶等。
競爭性抑制劑的結構特徵
①底物類似物例如,α-葡糖苷酶抑制劑如阿卡波糖(acarbose)、伏格列波糖(voglibose)和米格列醇(Miglitol)
②過渡態類似物如苯甲醯丙氨醛是胰凝乳蛋白酶的過渡態抑制劑。
③其它化合物有些化合物的平面結構與底物並不相似,但立體構象十分相近,也成為競爭性抑制劑。某些競爭性抑制劑的作用原理是抑制劑與一些酶活性中心的金屬離子絡合,妨礙了底物的進入,從而起到抑制酶活性的目的。
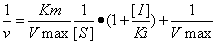 競爭性抑制劑
競爭性抑制劑競爭性抑制作用的雙倒數方程
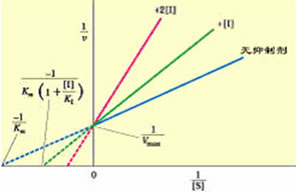 競爭性抑制劑
競爭性抑制劑更詳細的分析,可以由此參考雙倒數方程與米氏常數相關的資料。
競爭性抑制作用Ki的求解方法
①從雙倒數圖計算出表觀米氏常數Kmapp,然後代入Kmapp=Km(1+[I]/Ki)可計算出Ki。
②從雙倒數圖求得各I濃度下的Kmapp值對相應[I]再作圖,從再製圖的縱截距可直接測得Km,從其橫截距可直接測得Ki。
③從不同固定[I]下所作一簇直線的斜率1/S對相應[I]再製圖,其縱截距為Km/Vmax,斜率為Km/VmaxKi,橫截距即為-Ki。
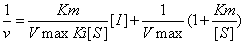 競爭性抑制劑
競爭性抑制劑競爭性抑制劑的IC50值的計算公式
首先由此查看有關IC50的定義。它的值取決於實驗所用的酶和底物濃度,當酶的濃度固定時,IC50值與Ki、Km和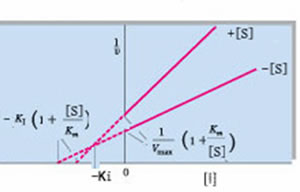 競爭性抑制劑
競爭性抑制劑根據該方程式,當底物濃度大於Km值時,IC50值高於Ki值,尤其當底物濃度較高時,Ki值偏低更加明顯。
酶相關名詞
酶 | 酶動力學 | 催化常數 | 酵素梅 | 競爭性抑制 | 非特異性抑制劑 | 酶多重性 | 多酶體系 | 開特 | 全酶 | 米氏常數 | 酶催化機制 | 催化部位 | 非競爭性抑制 | 抑制結構域 | 酶多態性 | 多酶複合物 | 活化能 | 米氏方程 | 鎖鑰學說 | 催化亞基 | 反競爭性抑制 | 協同催化 | 酶解作用 | 活性部位 | 同工酶 | 米氏動力學 | 誘導契合學說 | 不可逆抑制 | 非特異性抑制 | 協作抑制 |酶複合物| 酶活性 | 最適pH | 酶原 | 雙倒數作圖法 | 催化活性 | 可逆抑制 | 競爭性抑制劑 | 反饋抑制 | 酶系 | 酶單位 | 最適溫度
