活度概念
物理化學中, 活度(Activity)即某物質的“有效濃度”,或稱為物質的“有效摩爾分數”。此概念由吉爾伯特·牛頓·路易斯首先提出。
將理想混合物中組分B的化學勢可以表示為
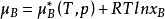 活度係數
活度係數根據Raoult定律,對於非理想液態混合物可表示為
 活度係數
活度係數因此,對非理想液態混合物組分B的化學勢可表示為
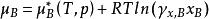 活度係數
活度係數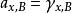 活度係數
活度係數a是B組分用摩爾分數表示的活度,γ稱為組成用摩爾分數表示的活度因子,也稱為活度係數,它表示在實際混合物中,B組分的摩爾分數與理想液態混合物的偏差。
電解質的活度係數通常可由測定電動勢、溶解度和凝固點等求得。活度係數的大小受溫度、水的介電常數、離子的濃度和價數等影響。為使理想溶液(或極稀溶液)的熱力學公式適用於真實溶液,用來代替濃度的一種物理量。
計算
非理想稀溶液
1、溶質濃度用摩爾分數表示的化學勢形式
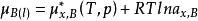 活度係數
活度係數2、溶質濃度用質量摩爾濃度表示的化學勢形式
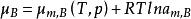 活度係數
活度係數3、溶質濃度用物質的量濃度表示的化學勢形式
 活度係數
活度係數活度和活度因子求法
1、蒸汽壓法
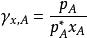 活度係數
活度係數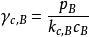 活度係數
活度係數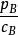 活度係數
活度係數對於溶劑,,式中pA是蒸汽壓的實測值。對於溶質,,式中pB是蒸汽壓的實測值。對cB作圖,即可得出活度係數。
2、圖解積分法
利用吉布斯-杜亥姆公式可以從溶質(劑)的活度求溶劑(質)的活度。如果從實際求得組分A的活度求得組分B的活度,實測B的活度值與計算值一致,則稱他們滿足熱力學一致性。
如,根據Gibbs-Duhem公式在等溫等壓時:
 活度係數
活度係數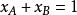 活度係數
活度係數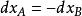 活度係數
活度係數可得,
 活度係數
活度係數 活度係數
活度係數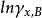 活度係數
活度係數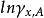 活度係數
活度係數如果以對作圖,用圖解積分法可求出。
歷史
提出
活度概念的引入和發展
活度的概念首先由劉易斯(G.N.Lewis)於1907年提出,迅速被套用於電化學,以測定水溶液中電解質的活度係數。
引用
30年代中期奇普曼(J.Chipman)將活度概念引用於冶金熔體,並提出金屬溶液中以1%濃度溶液為活度標準態,此建議迅速為冶金物理化學工作者所接受而推廣採用。華格納(C.Wagner)於1952年建議Ln γi按麥克勞林(McLaurin)級數展開,奠定了冶金熔體中多組分活度係數計算的基礎。50~60年代二十年間活度及活度相互作用係數的測定研究工作非常活躍,主要採用化學平衡及溶解度法,已逐步發展自成體系,成為經典的實驗方法。60年代末期固體電解質定氧電池開始作為測定黑色及有色金屬熔體中氧的活度及相互作用係數的良好手段。70年代,黑色冶金的金屬液及熔渣的活度數據已測出不少,但尚不完全。對有色金屬、特別對熔鋶及熔鹽等的活度數據則待做的工作更多。
發展
活度不能解決冶金熔體的結構問題。它能指出組分在真實溶液與理想溶液中熱力學作用上的偏差,但不能提供造成偏差的原因。長期以來不少學者提出組分相互間的結構模型,藉助於統計熱力學進行計算,企圖導出一系列公式以之對組分的活度係數進行預測,這對某些二元合金取得了一定的成功,但這些半經驗公式只適用於某一特殊體系的物質,或某一體系的特殊的濃度範圍,迄今尚未能找出適用於不同類型的普遍的合金體系的通用表達式。通過濃度坐標的適當轉換,對某些二元合金稀溶液的企圖得到活度參數與濃度參數線性關係的嘗試,也尚未獲圓滿的成功。
影響
總之,活度套用於冶金過程,使得冶金反應能定量地進行熱力學計算和分析,在闡明多種反應能否選擇地進行,在控制調整產物能否達到最大產率,在控制冶煉操作如何在最最佳化條件下進行等等方面,已經起了並將繼續起到應有的作用。冶金溶體(包括固溶體及水溶液)中組分活度的測定,利用活度探索熔體結構,以及從構想的結構預測組分的活度及其他熱力學性質等,將仍是今後較長期的較重要的研究課題。

