概況
從能源統計角度,熱力是指可提供熱源的熱水、過熱或飽和蒸汽;包括工業鍋爐、公用熱電站和企業自備電站生產的熱水和蒸汽,使用單位的熱水和蒸汽。
熱力的計算
蒸汽和熱水的勢力計算,與鍋爐出口蒸汽、熱水的溫度和壓力有關,計算方法:
第一步:確定鍋爐出口蒸汽和熱水的溫度和壓力,根據溫度和壓力值,在焓熵圖(表)查出對應的每千克蒸汽、熱水的熱焓;
第二步:確定鍋爐給水(或回水)的溫度和壓力,根據溫度和壓力值,在焓熵圖(表)查出對應的每千克給水(或回水)的熱焓;
第三步:求第一步和第二步查出的熱焓之差,再乘以蒸汽或熱水的數量(按流量表讀數計算),所得值即為熱力的量。
熱力狀態
狀態可能是平衡的,也可能是非平衡的(見熱力平衡)。經典熱力學研究的通常是熱力平衡狀態和由平衡狀態所組成的過程。用於描述熱力系統狀態的物理量稱為熱力狀態參數,或簡稱狀態參數,如壓力、溫度和比容等。狀態參數的數值僅僅取決於熱力系統的狀態,而與達到這種狀態所經歷的熱力過程無關。因此,給定的狀態有確定的狀態參數值。換句話說,當一個狀態參數的數值發生變化時,熱力系統的狀態也就發生變化。臨界狀態是熱力狀態的一種特定情況。
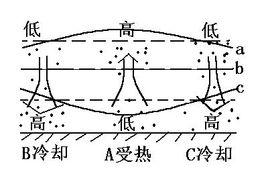
熱力環流
由於地面冷熱不均而形成的空氣環流,稱為熱力環流。它是大氣運動的一種最簡單的形式。
簡介
編輯
太陽輻射能的緯度分布不均,造成高低緯度間的熱量差異,
熱力環流的形成
引起大氣運動。
近地面空氣的受熱不均 ,引起氣流的上升
或下沉運動, 同一水平面上氣壓的差異和大氣的水平運動都會影響熱力環流的變化。
熱力環流是大氣運動最簡單的形式,由於地面的冷熱不均而形成的空氣環流。其形成過程為:受熱地區大氣膨脹上升,近地面形成低氣壓,而高空形成高氣壓;受冷地區相反,從而在近地面和高空的水平面上形成了氣壓差,促使大氣的水平運動,形成高低空的熱力環流。熱的地方空氣受熱膨脹上升,冷處收縮下沉。於是上空相同高度處,熱地方單位面積空氣柱重量(即氣壓)大,冷地方高空氣壓小,高空形成熱-冷的氣流。熱處氣流流失後,整個空氣柱減輕,地面形成低壓,冷處則形成高壓,近地面形成冷-熱的氣流
熱力環流中氣壓值的判斷
。加上上升、下沉氣流,構成了熱力環流。
熱力環流在現實生活中存在較為廣泛,例如山谷風、海陸風、城市風等都是熱力環流的具體體現。
熱力環流與城市規劃。城市內部由於人類活動排放大量餘熱,與郊區相比呈現“熱島效應”。城市與郊區之
間會形成熱力環流,為保護城市大氣環境,在城市規劃時,要研究城市風的下沉距離。一方面將大氣污染嚴重的工業布局在城市風下沉距離之外,以避免工廠排放的污染物流向城區;另一方面,應將工業衛星城建在城市風環流之外,以避免相互污染。
關於海陸風:白天吹海風,夜晚吹陸風。主要原因是水的比熱容大。水的比熱容是4.2*10^3焦耳每千克攝氏度 。
套用
編輯
孔明燈、熱氣球利用了熱力環流原理加熱;暖氣片、電熱油汀利用了熱力環流原理升高房間溫度。
驗證實驗
編輯
實驗方法
在一個用保鮮膜封閉的透明玻璃箱內,一邊放冰塊,一邊放沙子,當把一支點燃的香放入冰塊一側時,就能明顯的看到煙在箱內進行循環流動。(圖中虛線箭頭表示煙霧的運動方向。沙子最好預先在陽光下曬段時間,這樣效果更明顯。)
觀察實驗
方法1實驗器材:長方形的玻
熱力環流實驗
璃缸(長100厘米左右,寬3
0左右,高40厘米左右)、膠合板或塑膠薄膜、一盆熱水、一盆冰塊、一束香、火柴等。
實驗步驟:①將一盆熱水
和一盆冰塊分別放置在玻璃缸的兩端;
②用平整的膠合板或塑膠薄膜將玻璃缸上部開口處蓋嚴;
③在膠合板或塑膠薄膜的一側(裝冰塊的盆上方)開一個小洞;
④將一束香點燃,放進小洞內。
學生觀察煙霧在玻璃缸內是如何飄動的,能否發現什麼規律?由實驗可以得出什麼樣的結論?
方法2:關閉教室的門窗,儘量保持教室的氣流穩定。點燃兩根較粗的香,兩支香擺放的距離大約在30~40厘米左右,一支香旁邊放一個1000瓦的電熱爐、另一支香旁邊放一個較大的冰塊,將電爐通電5分鐘後,讓學生觀察衛生香菸的飄動方向。將電爐和冰塊交換位置,觀察煙的飄移方向。
在這個實驗中,電爐上方空氣加熱,氣壓降低;冰塊上方空氣冷卻,氣壓升高。香的煙總是飄向電爐上方,說明熱的地方近地面產生低氣壓,氣流從冷的地方流向熱的地方,而高空氣流則由熱的上空流向冷的上空。
熱力過程
熱力過程,熱力系統在某種因素推動下發生狀態變化的過程,熱力過程的特點反映在過程方程上,過程方程描述受特定過程約束的熱力狀態參數間的函式關係,由此可得出系統變化前後的狀態參數關係式。
簡介編輯
定容過程
容積V保持不變的熱力過程,又稱等容過程,例如密閉容器內的加熱或冷卻過程。過程方程為:V=常數,因此根據狀態方程有:式中p1、p2、T1、T2、分別為系統初、終態的壓力和溫度。定容過程在p-V圖(見圖)上由垂直線1-2表示。它表明系統對外不作功,向系統輸入的熱量Q全部轉變成系統內能U的增加,即式中m為系統的質量,cv為定容比熱容。
定壓過程
壓力p保持不變的熱力過程,又稱等壓過程。例如在大氣壓力下,氣缸中氣體的受熱膨脹。過程方程為:p=常數,因此V1/V2=T1/T2。它在p-V圖上由水平線3-4表示。這時,系統對外所作的功
W=p(V2-V1)=m﹙R÷M﹚(T2-T1)=nR(T2-T1)
外界向系統輸入的熱量
Q=H2-H1=mcp(T2-T1)
式中R為理想氣體的通用氣體常數,cp為定壓比熱容;H為系統的焓。
定溫過程
溫度T保持不變的過程,又稱等溫過程。例如室溫下緩慢地壓縮氣體的過程。過程方程為:T=常數,因此,p1V1=p2V2。它在p-V圖上由等邊雙曲線5-6表示,過程中向系統輸入的熱量等於系統對外界所作之功,右圖公式中ln為自然對數。
複雜過程/熱力過程編輯
絕熱過程
系統與外界沒有熱量交換的熱力過程。例如氣體在氣缸內的絕熱膨脹。可逆的絕熱過程在過程進行中其熵不變,故又稱定熵過程。過程方程為:pV=常數,因此有:式中,稱為絕熱指數或比熱容比,其中cv為定容比熱容。絕熱過程在p-V圖上表示為
高次雙曲線7-8,這時系統對外界所作的功。
多變過程
符合過程方程pV=常數,其中多變指數n在過程中保持不變的熱力過程。參數關係式為過程中向系統輸入的熱量系統對外界所作的功當多變指數n值分別取0、1、γ、±∞時,多變過程就相應地成為前面提到的定壓、定溫、絕熱和定容過程。