簡介
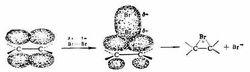 溴鎓離子
溴鎓離子名稱:溴鎓離子()
組成:溴提供電子與碳正離子成鍵,即帶上正電荷的溴離子。
形成過程
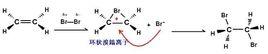
反應:溴與烯烴發生加成反應,形成環狀正離子。
鹵族元素的原子半徑如下:
| 元素符號 | 元素名稱 | 原子半徑 |
| I | 碘 | 0.133nm |
| Cl | 氯 | 0.099nm |
| Br | 溴 | 0.114nm |
| F | 氟 | 0.064nm |
對比可知,由於溴的原子半徑較大,第四層上有兩個s電子,5個p電子。因此溴最外層的p電子軌道就會接近碳正離子的空p軌道,溴的孤電子對容易與碳正離子 p軌道發生重疊,即電子云的離域。所以在碳正離子和溴之間形成一個價鍵,其中一對電子全部由溴供給。這樣一來,原來碳正離子的周圍由本來的6個電子變成了8個電子,而溴此時也形成了周圍有8個電子的穩定結構。 然後Br-從溴鎓離子的反面進攻環上的任一碳原子,生成反式加成的產物。
結論
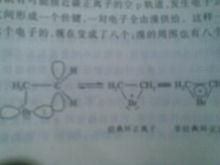 溴鎓離子中間體
溴鎓離子中間體烯烴分子中的π鍵與鹵素(碘除外)的加成是分步進行的離子型反應,屬於親電加成。其中一種是先生成碳正離子;另一種是先生成碳翁離子。加氯時有時經過碳正離子,有時經過環狀氯正原子,而加溴時主要經過環狀的正離子,即鎓離子。