非碳正離子的提出
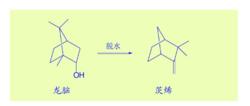
十九世紀末,wagner龍腦脫水成茨烯,認為其中存在碳骨架的異構化重排。
 非經典碳正離子
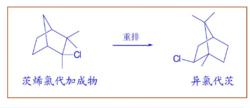
非經典碳正離子1922年,Meerwein研究茨烯氯代加成物重排為異氯代茨的反應,發現反應速率隨著溶液介電常數的增加而增加;氯化氫,氯化鐵,氯化鋁都能催化這個反應。
 非經典碳正離子
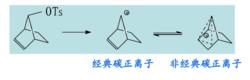
非經典碳正離子1939年,wilson經過進一步的研究發現,他認為形成的碳正離子具有兩電子三中心的結構,由於正電荷是離域的,能量較低,容易形成,因此導致反應的加速進行。
非碳正離子定義
正電荷通過不在烯丙基位上的雙鍵或三鍵甚至單鍵而發生離域的碳正離子,又稱碳鎰離子,是一個通過閉合多中心鍵分布正電荷的離域碳正離子,其碳原子呈五價,是二電子三中心鍵。
與碳正離子的區別
經典碳正離子的正電荷是定域的或通過稀丙位共軛離域。
非經典碳正離子的正電荷是通過非烯丙位共軛離域的。與空間位置有關。
 非經典碳正離子
非經典碳正離子 非經典碳正離子
非經典碳正離子非經典碳正離子的正電荷一般離域在三個碳原子之間,其中兩個碳原子彼此通過 鍵鍵合在一起,而第三個碳原子則是通過二電子三中心鍵與其它兩個碳原子鍵合在一起,呈橋型結構。倒如,降冰片基正離子⑴即屬於非經典碳正離子:
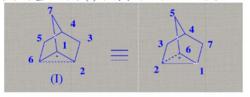 降冰片基正離子
降冰片基正離子(I)中C-6是5配位,C-1和C-2是4配位,被稱為非經典碳正離子。通常認為,C-1和C-2上各具有1/2正電荷,非經典碳正離子是C-6碳原子的sp3雜化軌道與C-1和C-2兩個碳原子的p軌道交蓋而成的。
非碳正離子的形成
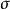 非經典碳正離子
非經典碳正離子非經典碳正離子可以通過鄰基參與形成,既可以通過π鍵參與,也可以通過 鍵的參與而形成。鄰基參與也稱鄰基效應,是一種分子內的SN2反應,反應的最終結果,或促進反應速度的異常增加,或限制產物的構型,或導致環狀化合物生成,或幾種情況兼而有之。
(1)π鍵參與
甶於對甲苯磺酸基處於碳碳雙健的反側,碳碳雙鍵參與幫助對甲苯磺酸基離去,同時π軌道與缺電子碳原子的 P軌道相互交蓋形成了非經典碳正離子 (1), 使正電荷得到分散 ,穩定了碳正離子,因此加速了反應的進行。由於非經典碳正離子在原雙鍵這一側形成,阻礙了親核試劑 HOAc從原 C=C 雙鍵這一側進攻 C- 7,而只能從反側 進攻 ,因此產物和反應物的構型相同 。
 非經典碳正離子
非經典碳正離子只有甲基所連線的碳原子是非經典碳正離子的組成部分,通過甲基的給電子效應才能使非經典碳正離子穩定,從而證明了反應過程中生成了非經典碳正離子。
 非經典碳正離子
非經典碳正離子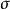 非經典碳正離子
非經典碳正離子(2)鍵參與
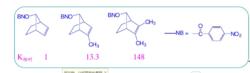
1949年 ,Winstein在研究 2-降冰片基對溴笨磺酸酯的乙酸解反應時,發現如下特徵:①無論外型底物還是內型底物都得到外型產物。②反應速率取決於離去基團在 exo或 endo;③具光學活性的外型底物溶劑解得到完全消旋的產物,而光學活性的內型底物則給出8%的淨構型轉化產物,即54%的構型轉化和46%的構型保留。④外型底物的旋光活性消失速率高於溶劑解速率,其比值為4.6,而在相同條件下,光學活性的內型底物沒有此現象。
 非經典碳正離子
非經典碳正離子 非經典碳正離子
非經典碳正離子在外型和內型的對溴苯磺酸-2-降冰片酯的乙酸解反應中,決定反應速度的步驟是碳正離子的生成。在外型底物中,由於C-1和C-6之間的鍵(成鍵電子)與離去基呈反式交叉構象,幫助了-OBs的離去,直接形成了橋型非經典碳正離子;而內型底物沒有此有利條件,可能先形成經典碳正離子,然後再離域成非經典碳正離子。因此,外型底物的溶劑解速度更快。
重要的相關知識-碳正離子
定義
碳正離子是有機化學反應中常見的活性中間體,對它的穩定性和反應活性的研究對某些有機反應歷程的闡明是十分重要的,同時對碳正離子穩定性的研究,有助於判斷反應是按何種反應歷程進行,有助於推斷反應所生成的主要產物。
結構和生成
 碳正離子
碳正離子碳正離子是只有6個價電子的缺電子物種,具有高度的親電性。中心碳原子可以採取sp2雜化,呈平面型結構,未參與雜化的P軌道與該平面垂直;中心碳原子或者可以採取sp3雜化,呈角錐型結構,空著一個未占的sp3雜化軌道。
碳正離子大多採取 sp2雜化的平面型結構,這可能是空間效應及電子效應共同作用的結果: 平面型結構使與中心碳相連的三個基團相距較遠; sp2雜化較sp3雜化含有更多的S成分,更靠近原子核;sp2雜化中,空的2p軌道上下兩瓣都可以發生溶劑化作用。通過拉曼光譜 、核磁共振及紅外光譜 等可以證明 , 簡單的烷基碳正離子均為平面結構。
碳正離子的形成過程大概是這樣的: 碳原子上原本連有一個電負性較大的或者吸電子的基團(如-Br, -OH等) 那么這個基團就會將它連線的碳上的電子吸引過去 使該碳稍微顯正電性吸電子基團在適當溶液中還可能帶著一對電子離去(例如溴離子 ),那么剩下的烴基就形成了碳正離子。
碳正離子的種類
碳鎓離子被歸類為伯,仲,或叔碳正離子,取決於結合到離子化的碳的碳原子的數目是否為1,2或3。
Alkylium離子
碳鎓離子可以直接從製備烷烴除去一個氫負離子,用強酸。例如,魔酸,混合物五氟化銻和氟硫酸變為異丁烷陽離子。
鎓離子
從分子它的名字源於托品(本身命名為分子阿托品)。所述鎓陽離子的鹽可以是穩定的,如鎓四氟硼酸鹽。它可以從被製成環庚三烯(tropylidene)和溴或五氯化磷。它是一個七邊形的,平面的,環狀的離子;它也有6π電子(4n+2個,其中,n=1),這滿足休克爾規則的芳香。它可以作為一個坐標配位體,以金屬原子。
三苯甲基陽離子
三苯基陽離子,是特別穩定的,因為該正電荷能夠在10中的碳原子(在3個碳原子的分布鄰和對位這三個苯基基團的位置,再加上中心碳原子)。它存在於化合物中的三苯基甲基六氟磷酸鹽和高氯酸三苯基。
Arenium離子
一個arenium離子是顯示為在一個反應中間體一環己二烯基陽離子電芳香取代。由於歷史原因,這種複雜的也被稱為韋蘭德中間體,或σ絡合物。兩個氫原子在垂直於苯環鍵合到一個碳位於一個平面內的arenium離子不再是一個芳香物質;然而它是由於離域相對穩定:正電荷經由離域超過5個碳原子的π系統。
Acylium離子
一個acylium離子是與式RCO陽離子。的結構被描述為RC≡O或RC=O。它是合成的和反應性當量的醯基碳陽離子的,但實際的結構具有的氧和碳通過三鍵連線。這些物種是常見的活性中間體,例如,在弗里德爾-克拉夫茨醯化也在許多其他有機反應。

