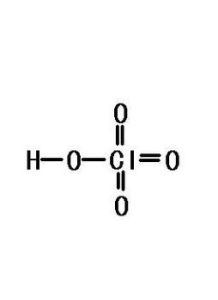
簡介
 各氧化態氯酸的空間構型圖及其各電勢
各氧化態氯酸的空間構型圖及其各電勢氯酸,即氯的含氧酸,其中氯的氧化態為+5.HClO 僅存在於溶液中,是一種強酸(≈−1)。水溶液在真空中可濃縮到密度1.282,即濃度40.1%。熔點<-20℃,溶解度(水)為>40g/100 ml (20 °C)加熱到40℃時即分
解,並發生爆炸。濃酸淺黃色,有類似硝酸的刺激性氣味。稀酸無色,在常溫時沒有氣味。有強烈氧化性,可用於製取多種氯酸鹽。由氯酸鋇溶液與硫酸作用後,經過濾、蒸濃而得。熱力學上,氯酸是不穩定的,會自發發生歧化反應。
化學性質
濃度在30%以下的氯酸冷溶液都是穩定的,40%的溶液也可由減壓下小心蒸發製取,但氯酸濃度在超過40%時會發生分解,並劇烈爆炸,產物不一:
8HClO=====4HClO+2HO+3O↑+2Cl↑
3HClO ====HClO + HO + 2ClO↑
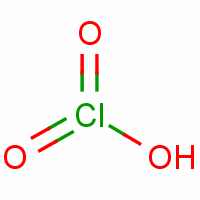 氯酸
氯酸(產生大量氣體,爆炸效果與硝酸銨類似)
有強烈氧化性(略弱於溴酸但強於碘酸,硫酸),常用作強氧化劑.它與金屬反應一般不生成氫氣,濃度較高的氯酸與銅反應會生成ClO氣體。
在普通的化學式組成中,ClO常以原子團的形式出現,如KClO等。
合成方法
1.由氯酸鋇和稀硫酸反應,濾去硫酸鋇沉澱後即得。
Ba(ClO3)2+H2SO4====BaSO4↓+2HClO3
2.或用次氯酸加熱歧化的反應製取:
3HClO ==△==HClO3+ 2HCl