簡介
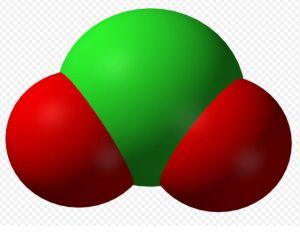 亞氯酸根離子
亞氯酸根離子製備
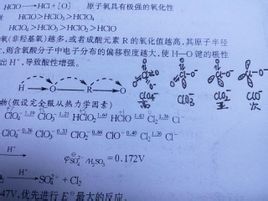
①ClO2在水中分解:2ClO2+H2O→HClO2+HClO3
②通ClO2於Na2O2或NaOH與H2O2可得亞氯酸鹽
2ClO2+Na2O2→2NaClO2+O2;2ClO2+H2O2+OH-→2ClO2-+O2+H2O
性質與用途
①非常不穩定的化合物,但亞氯酸鹽較穩定。
②具有漂白性(HClO,HClO2,HClO3都有漂白性,一般用NaClO2加到水中從而生成HClO2)
補充:亞氯酸化學式:HClO2
氧化性與酸性的排列相反
由氯的+3氧化態的形成的含氧酸,只存在與溶液中。理論上酸酐為Cl2O3,實際上不存在這種物質。
6NaOH+Cl2O+4ClO2=6NaClO2+3H2O
亞氯酸的鹽在水中普遍較穩定,但都是危險的,加熱或撞擊會立刻發生爆炸,分解為氯酸鹽等產物。例如
4NaClO2=2NaCl+2NaClO3+O2↑
亞氯酸鹽具有氧化性和漂白性,可作氧化劑或漂白劑,同時也是製備二氧化氯的原料之一。