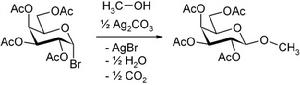
這個反應的產物是立體構型專一的,新生成的-OR基團與鄰位的-OAc基位於反式。其原因是乙醯氧基的雙鍵氧原子對反應中間體鄰位碳正離子產生作用,發生鄰基參與效應,生成五元環的中間體,然後醇的氧原子從五元環的外側進攻,生成-OR在-OAc另一側的糖苷產物。酯基普遍提供良好的鄰基參與,但是醚(例如苯甲基醚、甲基醚)則不然,通常得到立體異構體的混合物。
一般而言,Koenigs–Knorr反應使用氯代和溴代的糖類,但近來使用碘代糖的套用也有所增加。
Koenigs–Knorr反應可使用其他催化劑,例如多種金屬鹽類,包含溴化汞、氧化汞、氰化汞、三氟甲磺酸銀等。
其他糖苷化方法還有Fischer法(Fischer glycosidation)和Helferich法(Helferich method)。
