 幼年型慢性粒細胞白血病
幼年型慢性粒細胞白血病慢性白血病在小兒較少見,其中絕大多數為慢性粒細胞白血病(慢粒,CML)。CML在嬰兒時期其臨床及生物學特性與成人CML有顯著差別。因此可分為成人型和幼年型兩種類型。幼年型慢性粒細胞白血病(juvenile chronic myelogenous leukemia,JCML)在FAB分類中劃入骨髓增生異常綜合徵(MDS),與CML一樣、JCML累及多能造血幹細胞。本病以白細胞升高和脾腫大為主要特徵。急變後呈急性白血病表現。
流行病學
從出生到青少年均可患病,但以嬰幼兒為多見男性比女性多見。
病因
 幼年型慢性粒細胞白血病——病因
幼年型慢性粒細胞白血病——病因Ph1是CML的標誌性染色體變化,由非隨機t(9;22)(q34;q11)形成。在9號染色體斷裂點上有c-abl基因它的變異性可大於100kb。bcr基因位於22號染色體,是一個變異性很小的5.8kb DNA小片段,易位後22q-和9q+結合部形成bcr/abl融合基因,編碼一個特異的210kb蛋白質(P210),它是一種酪氨酸激酶,在腫瘤的發病中起作用。Ph1染色體在兒童CML中尚有它的特殊情況。
1.Ph1陰性CML 5%~10%有典型CML臨床表現的病例Ph1陰性,可能有以下原因:
(1)其他染色體片段結合於22q使Ph1的22q-在細胞遺傳學水平不易檢測到。
(2)9號染色體有斷裂或基因重排,但22q11未斷裂,分子生物學技術可檢測出CML Ph1陰性時的這些變化
2.Ph1陽性急性白血病 Ph1染色體並不只存在於CML中,3%~10%的兒童急性白血病有Ph1染色體。Ph1陽性急性白血病可以是CML急變也可能是原發的急性白血病。在臨床和血液學檢查中區別這兩種情況很困難,但細胞遺傳學結合分子生物學技術檢查可發現Ph1陽性急性白血病常為非CML特異的非隨機的染色體異常t(9;22)(q34;q11),有bcr基因以外的基因重排,並產生190kb蛋白(P190)在治療緩解後骨髓細胞中的Ph1染色體和P190即可消失而CML則相反,有CML特異的非隨機染色體異常t(9;22)(q34;q11),無論在疾病的哪一個時期,Ph1染色體和bcr基因重排所產生的210kb蛋白(P210)始終存在。
發病機制
 幼年型慢性粒細胞白血病
幼年型慢性粒細胞白血病CML發病機制至今不明,一般認為本病為多能造血幹細胞疾病,其發生與某些化學物質和遺傳因素有一定關係。1960年Nowell和Hungerford首次在費城發現CML患者有Ph染色體。目前大多數學者認為,Ph染色體對CML的診斷具有特殊意義,陽性率為70%~90%。1973年Rowley確定了Ph染色體是由於第9號和第22號染色體易位形成,即t(9:22)(q34:q11)。已知這種染色體易位,使正常位於9q34上的原癌基因C-ab1與22q11上的bcr癌基因融合,表達具有高酪氨酸蛋白激酶(PTK)活性的BCR-ABL融合蛋白,該蛋白被認為是CML發病的分子基礎。近兩年國外在分子水平上對CML的發病機制、BCR-ABL融合蛋白的多樣性及其與白血病表型的關係作了更深入的研究,已發現有3種BCR-ABL融合基因重排方式。因為ABL基因斷裂點的精確位置是易變的,可出現在此基因5’端>300kb的任何節段,而BCR基因的斷裂點叢集區主要有3個所以BCR-ABL融合基因根據BCR基因斷裂點位置分為3個主要類型:M-bcr、m-bcr、μ-bcr及6種BCR-ABL融合轉錄方式:b2a2、b3a2、b3a3、b2a3、e1a2e19a2。
1.M-bcr BCR基因斷裂點在5.8kb的主要斷裂點叢集區,即此基因的12-165外顯子區內,與ABL基因的融合轉錄方式有b2a2b3a2、b3a3、b2a3,編碼蛋白為P210。此型見於大多數CML和部分急性淋巴細胞白血病(ALL)P210 CML主要累及粒系,大部分細胞成熟受阻於中晚幼粒階段,而對紅系、單核系和淋巴系影響較小。
2.m-bcr BCR斷裂點位於更遠的上游區域,在外顯子e1和e2之間長54.4kb的內含子中,稱為次要bcr,與ABL融合轉錄方式為ela2,編碼融合蛋白P190。此型見於極少數CML和大部分ALLP190可同時累及粒、單細胞系,表現為絕對和相對單核細胞增多,成熟中性粒、單細胞之比低,有不同程度的嗜鹼性粒細胞增多,外周血幼稚粒細胞比例相對較高,中性粒細胞鹼性磷酸酶積分低。
3.μ-bcr BCR斷裂點位於外顯子e19和e20之間稱為3’端BCR斷裂點與ABL融合方式為e19a2,編碼融合蛋白P230,見於極少數慢粒急變和慢性中性粒細胞白血病(CNL)。此型主要特徵為成熟中性粒細胞增生為主,表現為“隱匿或良性”臨床經過,生存期較長。Ph+ 細胞可能因為BCR-ABL融合蛋白的異常改變,黏附骨髓基質細胞和其他細胞外基質成分的能力下降,使未成熟的細胞從骨髓釋放入血從而使未成熟的細胞逃避了骨髓基質微環境對其增殖分化的正常調控
研究還發現CML患者中有5%~10%Ph染色體陰性。Ph染色體陰性患者儘管細胞遺傳學未發現有t(9;22),但分子水平研究,Ph染色體陰性(Ph-CML)又可分為有bcr重組(Ph-bcr+CML)和無bcr重組(Ph-bcr- CML)兩個亞型大多數Ph‑CML患者為Ph-bcr+CML,Ph-bcr-CML患者僅為少數。一些作者認為後者可能是慢粒單白血病(CMML)分子生物學技術研究對Ph-CML的分型有重要意義,對患者的診斷、治療和估計預後有一定價值現認為Ph‑bcr+CML與Ph+CML有相同的臨床、血液學表現,並以同樣的方式發生急性變,對α-干擾素(IFN-a)的治療效果較好;而Ph-bcr-CML患者其臨床與血液學表現均不典型,對IFN-a的療效也較差。CML通常分為3期,即慢性期加速期和惡變期,後者是主要死因惟一有效的治療方法是骨髓移植(BMT),尤其是慢性期療效明顯優於晚期。因此,選擇最適當的BMT時間乃是病人長期存活的關鍵可是,至今仍無可靠的方法預測其惡變的時間。近年國外有人報導了一種新的分子基因標誌物,即第11號染色體短臂(11P)降鈣素(CT)基因異常甲基化改變可以監測CML惡化研究發現在慢性期,多為正常甲基化,但在疾病進展期可轉變成超甲基化。這種超甲基化的HpaⅡ片斷(3.1Kb)將提示CML在平均6個月內將發生惡變(在臨床表現及形態學惡變之前)。因此,CT基因高度甲基化可作為臨床監測疾病進展的分子基因標誌。通過對CT基因甲基化狀態的連續分析,可為臨床BMT選擇病人和爭取時間提供依據。
臨床表現
 幼年型慢性粒細胞白血病——臨床表現
幼年型慢性粒細胞白血病——臨床表現發病年齡<4歲多為12歲發病起病急,病程較短,類似AL。初發症狀常為反覆感染其次為出血、瘀斑、皮疹、腹痛骨痛及肝脾淋巴結中度腫大幼年型慢性粒細胞白血病累及多能造血幹細胞,外周血白細胞數增高,表現為發熱、肝脾淋巴結腫大、皮疹、出血、消瘦等。其白細胞數常為(15~85)×109/L(1.5萬~8.5萬/mm3);血小板數常為(25~100)×109/L(2.5萬~10萬/mm3);血紅蛋白值常為80~100g/L骨髓中粒細胞系統增生極度活躍,巨核細胞減少,周圍血中可見幼稚粒細胞幼稚單核細胞以及有核紅細胞。可能有黃瘤(xanthoma)及濕疹樣皮炎,此外,還可見到多發的牛奶咖啡色小皮疹(常見於神經纖維瘤),胎兒血紅蛋白(HbF)常升高,平均為38%有的高達70%但也有不升高者。Ph1染色體陰性。
併發症:
常並發反覆感染、出血、重度貧血,肝脾淋巴結腫大和骨痛,可並發黃瘤及濕疹樣皮炎,還可並發多發性牛奶咖啡色小皮疹(常見於神經纖維瘤)等等。
診斷
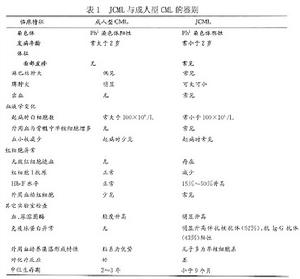 幼年型慢性粒細胞白血病——表1
幼年型慢性粒細胞白血病——表1小兒慢粒還沒有統一的診斷標準,1989年在貴陽召開的第二屆全國白血病治療討論會上訂出成人慢粒的診斷標準如下。
1.慢性期(chronic period of CML)
(1)臨床表現:無症狀或有低熱乏力、多汗、體重減輕等症狀
(2)血常規:白細胞計數增高,主要為中性中晚幼和桿狀粒細胞,原始細胞(Ⅰ型+Ⅱ型)≤5%~10%,嗜酸粒細胞和嗜鹼粒細胞增多可有少量有核紅細胞
(3)骨髓象:增生明顯至極度活躍以粒系增生為主中、晚幼粒和桿狀粒細胞增多,原始細胞(Ⅰ型+Ⅱ型)≤10%。
(4)染色體:有Ph染色體。
(5)cFu-GM培養:集落或集簇較正常明顯增加。
2.加速期(accelerated period of CML) 具有下列之二,可以診斷:
(1)不明原因的發熱、貧血:出血加重,和(或)骨骼疼痛。
(2)脾臟進行性腫大。
(3)不是因藥物引起的血小板進行性降低或增高。
(4)原始細胞(Ⅰ型+Ⅱ型)在血中及(或)骨髓>10%。
(5)外周血嗜鹼粒性細胞>20%
(6)骨髓中有顯著的膠原纖維增生
(7)出現Ph以外的其他染色體異常。
(8)對傳統的抗慢粒藥物治療無效。
(9)CFU-GM增殖和分化缺陷集簇增多集簇和集落的比值增高。
3.急變期(blastic crisis of CML) 具下列之一者可以診斷:
(1)原始粒細胞(Ⅰ型+Ⅱ型)或原淋加幼淋,或原單加幼單在外周血或骨髓中≥20%。
(2)外周血中原始粒加早幼粒細胞≥20%
(3)骨髓中的原始粒加早幼粒細胞≥50%
(4)有髓外原始細胞浸潤。
此期臨床症狀、體徵比加速期更惡化,cFu-GM培養呈小簇生長或不生長
鑑別診斷
1.與聯合免疫缺陷或先天性病毒感染相鑑別 幼年型慢粒需與聯合免疫缺陷或先天性病毒感染相鑑別,特別是持續的EB病毒感染,更與幼年型慢粒的臨床表現相似,但這些疾病都不會有幼兒慢粒的高胎兒血紅蛋白水平。
2.家族性慢性粒細胞白血病綜合徵(familial chronic granulocytic leukemic syndrome) Smith等(1974)報告兩對同胞同患家族性慢性粒細胞白血病綜合徵,其臨床表現亦與幼年型慢粒相似,但其生存期比幼兒慢粒明顯為長。
3.JCML與CML的鑑別 如表1所示。
檢查
 幼年型慢性粒細胞白血病——檢查
幼年型慢性粒細胞白血病——檢查實驗室檢查:
1.血液檢查 幼年型慢性粒細胞白血病累及多能造血幹細胞外周血多有重度貧血表現,網織紅細胞增加,外周血白細胞數增高(15~100)×109/L,白細胞計數白細胞分類以中性晚幼分葉核粒細胞為主,嗜鹼性粒細胞不增多。血小板減少,鹼性磷酸酶活力減低,相對於CML來說尚有以下特徵:外周血單核細胞比例>10%,幼稚細胞比例<5%;Hb-F升高;高丙種球蛋白血症。MDS伴有7號染色體單體時與JCML臨床表現相似,但Hb-F不高。
2.骨髓象 骨髓未成熟單核細胞增高,幼稚細胞比例<30%;沒有特殊的形態學異常,可見中性成熟粒細胞顯著增生,紅系、巨核系減少。
3.其他 Ph染色體陰性,胎兒血紅蛋白增高(40%~60%少數<9%)血紅蛋白A2減少。
其它輔助檢查:
常規做X線胸片檢查、B超檢查,其他根據臨床需要選擇。
1.X線平片 胸部X線平片可發現是否同時伴有縱隔增寬和肺門淋巴結增大骨X線平片可有蟲蝕樣病變或骨骺部白血病線。
2.腹部B型超聲或CT 可發現部分病例有不同程度的腎臟、肝臟的浸潤性病變及脾臟、腹腔淋巴結腫大有骨浸潤時骨掃描有異常濃集灶。
治療
化療療效有限,可單獨用6-巰基鳥嘌呤或與阿糖胞苷聯合套用。在多數病例中單純的對症及支持治療與採用化療者生存期相似。聯合強化療在少數病人中取得達2年的緩解期。成人型CML的藥物治療也可用於JCML治療。異基因骨髓移植是惟一有可能獲得長期無病生存的治療方法。移植後復發仍是個棘手的問題。
預後預防
 幼年型慢性粒細胞白血病——對比
幼年型慢性粒細胞白血病——對比預後:
JMML預後差,多數生存期低於2年,但其病程存在異質性,約1/3患兒無論是否治療,均表現為進展迅速而在數月內早期死亡1/3的患兒不經治療可獲得部分改善,生存期達2年以上。提示預後好的因素有:
1.年齡小於2歲者生存期長,特別是小於1歲者生存期明顯長。
2.HbF>10%。
3.血小板>40×109/L。
而外周血原始細胞和幼紅細胞多者預後差
預防:
1.避免接觸有害因素 避免接觸有害化學物質、電離輻射等引起白血病的因素,接觸毒物或放射性物質時,應加強各種防護措施;避免環境污染,尤其是室內環境污染;注意合理用藥慎用細胞毒藥物等。
2.大力開展防治各種感染性疾病,尤其是病毒感染性疾病做好預防接種。
3.做好優生工作,防止某些先天性疾病,如21-三體範可尼貧血等。加強體育鍛鍊注意飲食衛生,保持心情舒暢,勞逸結合,增強機體抵抗力。
