平均位能理論
正文
建立在對應態原理基礎上的一種溶液理論,可分為單液理論和雙液理論。根據對應態原理,保形液體的位形配分函式為:
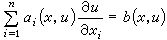
單液理論把混合物等價於一種假想液體,此液體每一分子具有混亂地為其他分子所包圍的平均位能,平均一對分子的相互作用特徵參數為〈ε*〉和〈r*〉,它們與混合物的組成有關。I.普里戈金提出,在一對分子的勢能函式為倫納德-瓊斯型,即
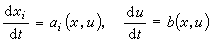 的情形下:
的情形下: 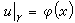
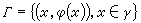
雙液理論把混合物等價於兩種假想液體混合而成的理想溶液。一種假想液體以 A分子為中心, 具有混亂地為其他分子所包圍的平均位能,平均一對分子的相互作用特徵參數為<ε壓>和<r壓>。另一種以B分子為中心,具有混亂地為其他分子所包圍的平均位能,平均一對分子的相互作用特徵參數為<ε壔>和<r壔>;普里戈金提出:
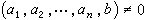
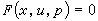
平均位能理論的適用範圍比保形溶液理論要寬一些,不局限於兩種分子大小和形狀相近的溶液,能夠對吉布斯函式GE和體積VE符號相反的現象給予與實驗結果較為符合的解釋。20世紀60年代後期,出現了平均位能的范德瓦耳斯型理論,與實驗結果比較,符合程度有所改進。