簡單分類套用
分類法是學習科學知識和從事科學研究行之有效、簡單易行的方法。根據需要可以有不同的分類方法,如交叉分類法、樹狀分類法等。
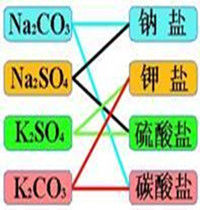
一種分類法
 交叉分類法
交叉分類法樹狀分類法
任何科學,為了研究,首先要對研究對象進行分類,樹狀分類法在化學中有著廣泛的套用,對我們學習化學會有很大的幫助,下面我們以物質的分類為例來加以分析。
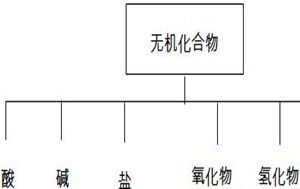
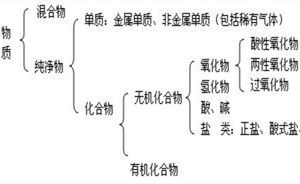
化學研究的近千萬種物質,可以從不同角度、按不同層次對它們進行多種分類:根據組成的成分是一種物質還是幾種物質,把物質分為純淨物和混合物;根據組成純淨物的元素是一種還是幾種,把物質分為單質和化合物;根據單質的性質把單質分為金屬和非金屬;根據化合物電離出的陽離子是否是氫離子,及是否全部是氫離子,或者陰離子是否全部是氫氧根離子,把某些化合物分為酸、鹼、鹽。
酸、鹼、鹽也可以分別進一步分類。
酸是在水溶液中發生電離,生成的陽離子全部是水合氫離子的化合物。根據酸在水溶液中電離度的大小,酸分為強酸和弱酸。根據酸分子中可以電離的氫原子個數,酸分為一元酸(如HNO3)、二元酸(如H2SO4)和三元酸(如H3PO4)。根據酸中是否含氧,酸分為含氧酸和無氧酸。無氧酸稱氫某酸。如HF叫氫氟酸,H2S叫氫硫酸。在無氧酸中,HCl、HBr和HI是強酸,其餘都是弱酸。簡單含氧酸通常叫某酸,如硫酸(H2SO4)、碳酸(H2CO3)。某一成酸元素如果能形成多種含氧酸,就按成酸元素的化合價的高低命名,如高氯酸(HClO4)、氯酸(HClO3)、亞氯酸(HClO2)、次氯酸(HClO)。
鹼是在水溶液中發生電離,生成的陰離子全部是氫氧根離子的化合物。根據鹼在水溶液中的電離程度,鹼分成強鹼和弱鹼。能全部電離的是強鹼,包括鹼金屬和鈣、鍶、鋇的氫氧化物;只能部分電離的是弱鹼,其他的氫氧化物都是弱鹼。
鹽是由金屬離子(包括NH4+)和酸根離子組成的化合物。根據組成不同,鹽可以分成正鹽、酸式鹽、鹼式鹽、復鹽和絡鹽等。既不含可以電離的氫原子,又不含氫氧根,這種鹽叫正鹽。由金屬離子和含有可以電離出氫原子的酸根所組成的鹽,叫做酸式鹽,如KHSO4、NaHCO3和NaH2PO4,它們分別叫硫酸氫鉀、碳酸氫鈉和磷酸二氫鈉。除金屬離子和酸根以外,還含有一個或幾個氫氧根,這種鹽叫鹼式鹽,如Cu2(OH)2CO3(鹼式碳酸銅)。復鹽是由兩種或兩種以上的金屬陽離子和一種酸根離子組成,如KAl(SO4)2·12H2O(明礬)。絡鹽(高中階段不深入研究),如Fe(SCN)3。
化合物中還包括氧化物,在氧化物中,凡是能與鹼反應只生成鹽和水的氧化物稱酸性氧化物,酸性氧化物也叫酸酐。多數非金屬氧化物,少數金屬高價態氧化物(如Mn2O7、CrO3)屬於酸性氧化物。凡是能與酸反應只生成鹽和水的氧化物稱鹼性氧化物。鹼性氧化物一定是金屬氧化物。既能與酸,又能與鹼生成鹽和水的氧化物為兩性氧化物,如Al2O3、ZnO等。既不能與酸反應生成鹽和水,也不能與鹼反應生成鹽和水的氧化物稱不成鹽氧化物。如CO、NO、H2O等。
我們可將上述物質分類的部分內容用樹狀分類法表示如下:
可見,樹狀分類法可以將繁雜的化學物質及其變化過程清晰地表示出來,方便我們學習的研究。
分散系其分類
分散系
把一種(或多種)物質分散在另一種(或多種)物質中所得到的體系。
分散質
被分散的物質。
分散劑
分散質分散在其中的物質,起容納分散質的作用。
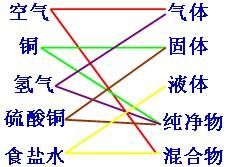
組合方式分類
分散系組合
 交叉分類法
交叉分類法三類分散系
按分散系中的分散質粒子的大小,分散系分為如下三類:
①溶液:分散質粒子直徑小於1nm(1nm=10-9m),溶液是均勻、透明的分散系,是三類分散系中最穩定的。
②膠體:分散質粒子直徑在1nm~100nm之間,在一定條件下能穩定存在,具有介穩性,即穩定性介於溶液和濁液之間,屬於介穩體系。
③濁液(懸濁液、乳濁液):分散質粒子直徑大於100nm,是三類分散系中最不穩定的。
注意:三類分散系的本質區別是分散質粒子的大小不同。
膠體的分類
①根據分散質微粒組成的狀況分類:
如:Fe(OH)3膠體膠粒是由許多Fe(OH)3等小分子聚集一起形成的微粒,其直徑在1nm~100nm之間,這樣的膠體叫粒子膠體。又如:澱粉屬高分子化合物,其單個分子的直徑在1nm~100nm範圍之內,這樣的膠體叫分子膠體。
②根據分散劑的狀態劃分:
如:煙、雲、霧等的分散劑為氣體,這樣的膠體叫做氣溶膠;AgI溶膠、Fe(OH)3溶膠、Ae(OH)3溶膠,其分散劑為水,分散劑為液體的膠體叫做液溶膠;有色玻璃、煙水晶均以固體為分散劑,這樣的膠體叫做固溶膠。
膠體的製備
製備膠體的必要條件是要使分散質粒子大小在lnm~100nm之間。製備方法原則上有兩種,一是使固體顆粒變小的分散法,一是使分子或離子聚結成膠體的凝聚法。
常用的分散法有研磨法、膠溶法等。研磨法是把粗顆粒的固體放在膠體磨中研細,在研磨的同時要加入明膠等穩定劑。膠溶法是通過向新生成並經過洗滌的沉澱中加入適宜的電解質溶液作穩定劑,再經攪拌,使沉澱重新分散成膠體顆粒而形成溶膠,這種過程稱為膠溶作用,如在新生成的Fe(OH)3沉澱中,加入少量FeCl3稀溶液可製得Fe(OH)3溶膠。
凝聚法有多種方法,套用也比分散法廣泛,主要可分為化學反應法、改換溶劑法等。所有反應,如複分解、水解、氧化還原、分解等,只要能生成難溶物,都可以通過控制反應條件(如反應物濃度、溶劑、溫度、pH、攪拌等)用來製備溶膠,這些被稱之為化學反應法。例如:
利用水解反應
教材中介紹的Fe(OH)3溶膠的製備,利用的就是FeCl3的水解反應:
FeCl3+H2OFe(OH)3(溶膠)+3HCl。
如果將鹼金屬矽酸鹽類水解,則可製得矽酸溶膠:
Na2SiO3+2H2OH2SiO3(溶膠)+2NaOH。
利用複分解反應
可用稀的AgNO3溶液與稀的KI溶液的反應來製備AgI溶膠:
AgNO3(稀溶液)+KI(稀溶液)AgI(溶膠)+KNO3。
關於改換溶劑法則是利用一種物質在不同溶劑中溶解度相差懸殊的性質來製備溶膠,如把松香的酒精溶液滴入水中,由於松香在水中溶解度很低,溶質以膠粒大小析出,即形成松香的水溶膠。
膠體的淨化
無論採用哪種方法,製得的溶膠常含有很多電解質或其他雜質,除了與膠粒表面吸附的離子維持平衡的適量電解質具有穩定膠體的作用外,過量的電解質反而會影響溶膠的穩定性。因此,製備好的溶膠常常需要作淨化處理,最常用的淨化方法就是滲析。下面介紹利用滲析的方法,將膠體中的雜質離子或小分子除去的實驗:膠體粒子能否透過半透膜的試驗。
(1)把10mL澱粉膠體和5mLNaCl溶液的混合液體,加入用半透膜製成的袋內,將此袋浸入蒸餾水中(半透膜可用雞蛋殼膜、牛皮紙、膠棉薄膜、玻璃紙等製成,它有非常細小的孔,只能允許較小的離子、分子透過,而膠體膠體粒子不能透過)。
(2)2min後,用兩支試管各取燒杯中的液體5mL,向其中一支試管里滴加少量AgNO3溶液,向另一支試管里滴加少量碘水,觀察現象(提示:碘水與澱粉膠體混合後溶液呈藍色)。
實驗現象:可以看到在加入AgNO3溶液的試管里出現了白色沉澱;在加入碘水的試管里並沒有發生變化。
實驗結論:Cl-能透過半透膜,從半透膜袋中擴散到了蒸餾水中,澱粉不能透過半透膜,沒有擴散到蒸餾水中。膠體分散質的粒子比溶液分散質的粒子大。
注意事項:①半透膜袋要經檢驗未破損,否則,澱粉膠體粒子也會進入蒸餾水。②不能用自來水代替蒸餾水,否則,實驗結論不可靠。③一般要在2min以後再作Cl-的檢驗,否則,Cl-出來的太少,現象不明顯。
說明:套用實驗的原理和方法,可以除去膠體溶液中的離子或小分子雜質。為了提高除雜的速度和提高除雜的程度,要定期更換蒸餾水。
膠體的性質
丁達爾效應
 交叉分類法
交叉分類法膠體為什麼能有丁達爾效應呢,在光的傳播過程中,光線照射到粒子時,如果粒子大於入射光波長很多倍,則發生光的反射;如果粒子小於入射光波長,則發生光的散射,這時觀察到的是光波環繞微粒而向其四周放射的光,稱為散射光或乳光。丁達爾效應就是光的散射現象或稱乳光現象。由於溶膠粒子大小一般不超過100nm,小於可見光波長(400nm~700nm),因此,當可見光透過溶膠時會產生明顯的散射作用。而對於真溶液,雖然分子或離子更小,但因散射光的強度隨散射粒子體積的減小而明顯減弱,因此,真溶液對光的散射作用很微弱。此外,散射光的強度還隨分散體系中粒子濃度增大而增強。所以說,膠體能有丁達爾效應,而溶液沒有,可以採用丁達爾效應來區分膠體和溶液。
布朗運動
布朗運動是微小粒子表現出的無規則運動。它是蘇格蘭植物學家布朗於1827年在顯微鏡下觀察水中的花粉時首次發現的。以後人們發現在溫度均勻和無外力作用的流體中都能觀察到這種運動。布朗運動是懸浮在液體中的微小顆粒受到液體各個方向液體分子撞擊作用不平衡造成的。布朗運動不是固體顆粒中分子的運動,也不是液體分子的無規則運動,而是懸浮在液體中的微小顆粒的無規則運動。布朗運動間接地證實了液體分子的無規則運動。
在膠體中,由於膠體粒子在各個方向所受的力不能相互平衡,也會產生無規則的運動,屬於布朗運動。布朗運動是膠體穩定的原因之一。布朗運動不是膠體獨有的性質,一些懸浮的顆粒,如花粉、藤黃等都存在布朗運動。
膠體凝聚
膠體分散系中,分散質微粒相互聚集成較大的顆粒而沉澱的現象稱為膠體的凝聚。能促使溶膠凝聚的外因有加電解質(酸、鹼及鹽)、加膠粒帶相反電荷的膠體、加熱等。
使膠體微粒聚集成較大顆粒形成沉澱而從分散劑里析出的過程,有時膠體在凝聚時,會連同分散劑一道凝結成凍狀物質,這種凍狀物質叫凝膠。
膠體凝聚的方法:
(1)加入少量可溶性電解質。加入的電解質在分散劑中電離,產生了與膠粒帶相反電荷的離子,從而中和了膠粒所帶電荷,消除了膠粒間的相互斥力,從而凝聚成大顆粒而沉澱。
(2)加入帶相反電荷膠體。同種膠體的膠粒帶相同的電荷。一般來說,金屬氫氧化物、金屬氧化物的膠體微粒吸附陽離子,帶正電荷,如Fe(OH)3膠體和Al(OH)3膠體微粒。非金屬氧化物、金屬硫化物膠體微粒吸附陰離子,帶負電荷,如As2S3膠體、H2SiO3膠體的微粒。當然,膠體中膠粒帶電的電荷種類可能與其他因素有關。
(3)加熱。加熱可加快膠粒運動速率,增大膠粒之間的碰撞機會,從而易使膠粒凝聚成大顆粒而沉澱。如對Fe(OH)3膠體加熱,很快會看到紅褐色的Fe(OH)3沉澱析出。
注意:膠體凝聚一般指膠體微粒聚集成較大的顆粒而析出的過程,是物理變化引起的凝聚。而蛋白質膠體的變性凝聚(蛋白質膠體在加熱、加重金屬鹽等條件下的凝聚),不屬膠體意義上的凝聚,此變性凝聚過程為化學變化。