基本內容
中文名稱:乙硫異煙胺
中文別名:2-乙基吡啶-4-硫代甲醯胺
英文名稱:ethionamide
英文別名:2-ethylisonicotinethioamide; 2-ethylpyridine-4-carbothioamide; 2-(ethylsulfanyl)pyridine-4-carboxamide
CAS號:536-33-4
EINECS號:208-628-9
分子式:C8H10N2OS
分子量:182.2428
InChI:InChI=1/C8H10N2OS/c1-2-12-7-5-6(8(9)11)3-4-10-7/h3-5H,2H2,1H3,(H2,9,11)
密度:1.241g/cm3
熔點:158℃
沸點:357.165°C at 760 mmHg
閃點:169.808°C
蒸汽壓:0mmHg at 25°C
藥品簡介
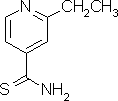 乙硫異煙胺結構式
乙硫異煙胺結構式乙硫異煙胺
藥物名稱: 乙硫異煙胺
藥物別名: 暫無
英文名稱: Ethionamide
藥物說明: 腸溶片:每片0.1g。
主要成分: 暫無
性狀特徵: 暫無
功能主治
對結核桿菌有抑菌作用,抗菌活性僅為異煙肼的十分之一。本品口服易吸收,體內分布廣,可滲入全身體液(包括腦脊液),在體內全部代謝為無效物。對滲出性及浸潤性乾酪病變療效較好。單獨套用少,常與其他抗結核病藥聯合套用以增強療效和避免病菌產生耐藥性。
用法用量
1日量0.5~0.8g,一次服用或分次服(以一次服效果為好),必要時也可從小劑量(0.3g/日)開始。
注意事項
(1)服藥後有噁心、嘔吐、腹痛、腹瀉、厭食、胃部不適等症狀,多於服藥2~3周后發生,如不能耐受,可酌減劑量或暫停服藥,俟症狀消失後繼續服用。如合用碳酸氫鈉,或服腸溶片,可減輕反應。在發生嘔吐時,可同時使用止吐藥物。 (2)少數患者有糙皮病症狀、精神抑鬱、視力紊亂和頭痛、末梢神經炎、經期紊亂、男子乳房女性化、脫髮、關節痛、皮疹、痤瘡等。 (3)20%~30%病人可對肝功能有影響,引起氨基轉移酶升高,並可發生黃疸,故每月應測肝功能一次。 (4)孕婦和12歲以下兒童禁用。 (5)大劑量可引起體位性低血壓。
藥物毒理
 藥物檢測
藥物檢測本品為異煙酸的衍生物,其作用機制不明,可能對肽類合成具有抑制作用。本品對結核分枝桿菌的作用取決於感染部位的藥物濃度,低濃度時僅具有抑菌作用,高濃度具有殺菌作用。抑制結核桿菌分枝菌酸的合成。本品與丙硫異煙胺片有部分交叉耐藥現象。
藥代動力學
 乙硫異煙胺
乙硫異煙胺口服迅速吸收(80%以上),廣泛分布於全身組織體液中,在各種組織中和腦脊液內濃度與同期血藥濃度接近。本品可穿過胎盤屏障。蛋白結合率約10%。服藥後1~3小時血藥濃度可達峰值,有效血藥濃度可持續6小時,T1/2約3小時。主要在肝內代謝。經腎排泄,1%為原形,5%為有活性代謝物,其餘均為無活性代謝產物。
藥物相互作用
 結核菌
結核菌1、與環絲氨酸同服可使中樞神經系統反應發生率增加,尤其是全身抽搐症狀。應當適當調整劑量,並嚴密監察中樞神經系統毒性症狀。2、本品與其他抗結核藥合用可能加重其不良反應。
3、本品為維生素B6拮抗劑,可增加其腎臟排泄。因此,接受丙硫異煙胺治療的患者,維生素B6的需要量可能增加。
注意事項
1、服藥後有噁心、嘔吐、腹痛、腹瀉、厭食、胃部不適等症狀,多於服藥2~3周后發生,如不能耐受,可酌減劑量或暫停服藥,俟症狀消失後繼續服用。如合用碳酸氫鈉,或服腸溶片,可減輕反應。在發生嘔吐時,可同時使用止吐藥物。
2、少數患者有糙皮病症狀、精神抑鬱、視力紊亂和頭痛、末梢神經炎、經期紊亂、男子乳房女性化、脫髮、關節痛、皮疹、痤瘡等。
3、20%~30%病人可對肝功能有影響,引起氨基轉移酶升高,並可發生黃疸,故每月應測肝功能一次。
4、孕婦和12歲以下兒童禁用。
5、大劑量可引起體位性低血壓。
結核治療
 肺結核透析片
肺結核透析片目的探討耐多藥肺結核患者採用3/力克肺疾、加替沙星、捲曲黴素、乙硫異煙胺、微卡/18力克肺疾、吡嗪醯胺或乙胺丁醇、乙硫異煙胺方案的臨床效果。方法2002年10月~2004年10月我院結核內科收治的包括對異煙肼和利福平在內的耐多藥肺結核患者32例,採用上述方案治療21個月。治療過程中每月檢查肝功能、痰結核菌、血常規、尿常規,每3個月拍胸部X線片或胸部CT片。結果32例完成治療後痰菌陰轉率為94%,隨訪12個月痰菌復發率為16%,肝功能異常率為19%,靜脈炎為3%。結論本方案治療耐多藥肺結核效果滿意,藥物副作用小,但費用較高,可用於臨床治療耐多藥肺結核患者。自套用標準抗結核化療方案後,尤其是近20年來,人們逐漸發現結核菌群中存在耐藥菌。隨著抗結核化療在全球廣泛推廣,不合理、不規律化療導致結核菌耐藥菌株的逐漸增加。耐藥性結核病,尤其是耐多藥結核病的治療已成為當今全球結核病防治中的一個難題。我院自2002年10月~2004年10月對32例住院耐多藥肺結核患者採用3/力克肺疾、加替沙星、捲曲黴素、乙硫異煙胺、微卡/18力克肺疾、吡嗪醯胺或乙胺丁醇、乙硫異煙胺方案治療,取得了較理想的短期治療效果,現報告如下。
臨床資料
病例選擇標準(1)復治排菌患者;(2)痰抗酸菌培養陽性且為人型或牛型結核菌;(3)至少對異煙肼和利福平耐藥;(4)心肝腎功能正常,無嚴重併發症;(5)年齡在18~60周歲。
病例來源32例耐多藥肺結核患者均為我院住院患者。男19例,女13例;18~20歲2例,21~30歲8例,31~40歲13例,41~50歲5例,51~60歲4例。
抗酸菌檢查32例患者痰抗酸菌檢查均為陽性,人型結核菌25例,牛型結核菌7例,除對異煙肼和利福平耐藥外,耐鏈黴素8例,耐乙胺丁醇11例,耐吡嗪醯胺2例。
既往史32例均為復治患者,肺結核病史1~5年12例,6~10年13例,11~20年5例,21年以上2例。
病變情況及類型32例患者均為繼發性肺結核,有5例同時合併結核性胸膜炎,或包裹性胸腔積液,病變限於一個肺野者3例,2個肺野10例,3個肺野11例,4個肺野7例,5個肺野1例。
臨床表現咳嗽31/32(97%),咳痰28/32(88%),發熱26/32(81%),氣短20/32(63%),胸悶13/32(41%),盜汗8/32(25%)。
方法
肺結核透析片
 與乙硫異煙胺結合藥物利福平
與乙硫異煙胺結合藥物利福平治療方案3/力克肺疾、加替沙星、捲曲黴素、乙硫異煙胺、微卡/18力克肺疾、吡嗪醯胺和(或)乙胺丁醇、乙硫異煙胺。力克肺疾0.3g/次,每日3次口服,加替沙星0.4g/d,1次靜點,捲曲黴素0.75g/d,1次靜點,微卡首次注射在化療開始的第2~4周,每隔2周注射1次,共6次,每次22.5μg。治療期間檢查強化期3個月住院治療,每個月查血常規、尿常規、肝功能,痰抗酸桿菌3次塗片,每3個月拍胸部X線片或胸部CT片,每3個月做1次痰結核菌培養。全程中有醫務人員或家屬督導保證按時用藥。
治療效果(1)觀察治療後3、6、9、12、15、18個月痰菌情況,停藥後1、3、6個月痰菌,X線胸片或CT情況。(2)臨床診斷標準:體溫在7天內降至正常為顯效,7~14天降至正常為有效;咳嗽、咳痰在14天消失為顯效,15~21天消失為有效;無力、盜汗在21天內消失為顯效,22~28天內消失為有效。(3)X線或胸部CT情況:病灶較原來減少2/3為顯效,減少1/3~2/3為有效,小於1/3為無變化。
結果
痰塗片或培養陰轉情況32例耐多藥肺結核患者經上述方案治療3個月痰菌轉陰78%(25/32),6個月轉陰88%(28/32),12個月轉陰91%(29/32),18個月轉陰94%(30/32),2例在完成18個月時仍陽性;療程結束後隨訪3個月痰菌轉陽2例(6%),6個月痰菌轉陽4例(13%),12個月痰菌轉陽5例(16%)。
症狀、體徵變化發熱12例,顯效6例,有效5例,總有效率92%;咳嗽31例,顯效25例,有效5例,總有效率97%;咳痰26例,顯效18例,有效5例,總有效率88%;咯血9例,顯效6例,有效3例,總有效率100%;無力24例,顯效18例,有效3例,總有效率88%。
影像學變化32例完成治療後X線胸片或肺CT片,3例滲出性病變完全吸收,24例以滲出伴乾酪性病變者有18例明顯吸收,5例伴有胸腔積液者3例積液完全吸收,2例形成包裹積液伴胸膜肥厚。
藥物不良反應32例患者抗結核治療過程中均常規給護肝片,有胃腸道反應者給胃黏膜保護劑。不良反應最多的是肝功能異常,多為轉氨酶升高占19%(6/32),但均未超過120u/L,其次為16%(5/32)出現胃腸道反應,3%(2/32)出現靜脈炎。上述反應均較輕微,在對症和密切觀察下繼續治療逐漸消失。
討論
與乙硫異煙胺結合藥物利福平
近20年來,以含異煙肼和利福平為主藥組成的抗結核治療方案在全國得到了廣泛的普及,使結核病的治療和控制工作取得了很大進步。但同時也出現了新的問題。近年來,耐藥結核病尤其是耐多藥病例逐年增加,給結核病的控制帶來了新的挑戰。本文採用含力克肺疾、加替沙星、捲曲黴素、乙硫異煙胺並微卡為主藥組成的治療方案,療程21個月,療效較滿意,痰菌陰轉率為94%,復發率為10%,症狀、體徵改善率在90%以上,影像上均有不同程度的好轉與吸收,藥物不良反應較輕,患者可以耐受,無因藥物不良反應停止治療者。筆者認為該方案治療耐多藥肺結核有效且較安全,但費用較高,是值得推薦的治療耐多藥肺結核病的方案。
不良反應文獻分析
目的
 乙硫異煙胺
乙硫異煙胺了解乙硫異煙胺致兒童及青少年不良反應的數量、類型、分布和特點。方法:檢索維普中文科技期刊資料庫1995年~2006年關於乙硫異煙胺不良反應的文獻,篩選收集16歲以下(含16歲)青少年及兒童不良反應的案例報告,統計各病例的性別、年齡、給藥方法、臨床表現、不良反應出現時間和轉歸等,並進行總結分析。結果:不良反應以6歲以下學齡前兒童為主,占60%以上,不良反應出現時間較短,2h內出現者占一半以上,類型及臨床表現呈多樣化。結論:對乙硫異煙胺在兒科的臨床套用要給予高度重視,以保障兒童用藥安全。 乙硫異煙胺(azithromycin,AZM)是紅黴素的化學結構修飾後得到的15元環大環內酯類抗生素,與紅黴素相比具有對酸穩定、半衰期長、組織藥物濃度高、抗菌譜廣等優點,臨床套用日趨廣泛,其不良反應(ADR)發生率亦增高,且新的不良反應屢有報導。為確保兒童用藥安全可靠,為兒科臨床醫師在使用該藥時提供參考,現將其所致兒童及青少年不良反應的相關文獻進行總結分析。
資料與方法
本文以題名為乙硫異煙胺檢索了維普中文科技期刊資料庫1995年~2006年的有關文獻,逐一查閱文獻,排除標準:(1)非不良反應案例報導文獻;(2)成人不良反應案例報導;(3)重複報導。收集16歲以下(含16歲)青少年及兒童不良反應的案例報告,進行歸納和總結。
病例情況
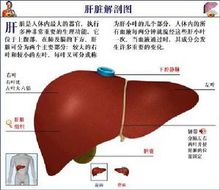 肝臟解剖圖
肝臟解剖圖檢索到符合條件的相關文獻29篇共36個病例,其中男21例,占58.3%,女15例,占41.7%;年齡7個月~16歲,其中≤2歲10例(27.8%),~6歲12例(33.3%),~12歲10例(27.8%),~16歲4例(11.1%);32例(88.9%)靜脈滴注給藥,4例(11.1%)口服給藥。不良反應發生時間最短是靜脈滴注即刻發生過敏反應,最長是口服8d後出現嚴重肝損害。0.5h內出現ADR14例(38.9%),0.5~2h出現ADR5例(13.9%),2~24h出現ADR3例(8.3%),1~6d出現ADR9例(25.0%),7d以上出現ADR2例(5.6%)。另有3例ADR出現時間不詳。36例乙硫異煙胺引起的兒童及青少年不良反應中,有3例(8.3%)劑量偏大或過量,其中1例嚴重過量,另有3例劑量不詳,其餘30例給藥劑量基本合理,占83.3%。
不良反應表現
除一般的消化道不適和輕微的皮膚過敏外,乙硫異煙胺在兒童及青少年還可引起過敏性休克、藥疹、中毒性肝炎、白細胞減少、腎損害等,其中以變態反應最為常見。
過敏反應及過敏性休克
36例不良反應中,過敏反應8例,有1例為口服給藥(乙硫異煙胺顆粒,服藥後10min即開始出現不適),其餘7例均給靜脈滴注,輸入即刻即出現反應。過敏性休克4例,均為靜脈滴注,輸入後10s~15min即出現反應。過敏和過敏性休克各有1例死亡,兩例年齡均<2歲,其餘病例經對症治療後均恢復正常。
蕁麻疹及藥疹
共有6例,年齡20月~8歲,其中蕁麻疹4例,多形性紅斑1例,過敏性紅斑1例。1例20月男性幼兒在口服乙硫異煙胺顆粒15min後出現蕁麻疹,1例6歲女童口服乙硫異煙胺顆粒20min後出現過敏性紅斑。6例患兒經對症治療處理後均完全恢復。
肝腎損害
出現肝損害3例,其中嚴重肝損害1例,肝毒性反應2例,3例均為年長兒,年齡分別為13歲、10歲、14歲,均為靜脈滴注給藥,均在原發疾病治療結束後2~3d開始出現不適。嚴重肝損害病例主要表現為出院3d後神志不清,時而煩躁、譫妄,口唇、面部紫紺,輕度水腫,呼吸困難,不能平臥,鞏膜輕度黃染,雙側瞳孔直徑5mm,光反射遲鈍,鼻翼扇動,頸抵抗(±),肝頸回流徵( )。2例肝毒性反應主要表現為停用乙硫異煙胺後2d出現乏力、厭食、噁心、腹部不適,無黃疸、腹瀉,血清ALT72.4U/L,AST66.3U/L,HbsAb( ),餘項均正常。腎損害1例,為2歲患兒在靜脈輸注乙硫異煙胺後1h出現血尿(紅細胞: ,蛋白: )。4例均在及時處理治療後完全恢復,隨訪未見異常。
心動過速
3例全為男性,均為靜脈給藥。1例在治療6d出現可逆性室上性心動過速,另外2例靜脈輸注開始80min、120min後出現心動過速,心率分別為170次/min、200次/min。3例經及時處理後均完全恢復正常。
嗜睡
鄭昌玲報導,乙硫異煙胺靜脈滴注引起4例小兒出現嗜睡。女3例,男1例,年齡分別為7月、22月、27月和1.5歲,出現時間2~4d,除嗜睡外未見其他不適,停用乙硫異煙胺後嗜睡迅速緩解,隨訪未見其他不良反應發生。
醉酒樣反應
董開宥報導1例5歲男性患兒,因支氣管炎並哮喘給予門冬氨酸乙硫異煙胺(博抗)125mg加入5%葡萄糖注射液150mL以40滴/min靜脈滴注,當藥液注入體內約100mL時,患兒突然啼哭不止,主訴心中難受、噁心,醉酒樣面容。第2次重複用藥時再次出現上述症狀,停用乙硫異煙胺換用頭孢呋辛,續用其他藥物,未再出現不良反應。
肢體末梢紫紺
王蓮紅報導,1例16歲患兒因上呼吸道感染予乙硫異煙胺0.5g靜脈滴注,無不適,次日發現雙手青紫但無其他不適,繼續輸入乙硫異煙胺約40min後發現雙手青紫加重,無其他不適,立即停藥,給予地塞米松10mg靜脈滴注,5min後青紫減輕,液體輸完後青紫消失。
精神錯亂
治療呼吸道感染
 治療呼吸道感染
治療呼吸道感染邱雪雁報導一8歲男性患兒因“急性上呼吸道感染”予門冬氨酸乙硫異煙胺0.25g加人5%GS250mL靜脈滴注。同時給予穿琥寧0.2g加人10%GS100mL靜脈滴注,安痛定對症處理,病情穩定回家。患兒回家後,口服了一些平時常用的“感冒”藥,體溫反覆,12h後,患兒出現精神錯亂(T38.2℃),表現為胡言亂語,煩躁不安,出現幻覺。再次就診,給予安定鎮靜處理,精神錯亂症狀逐漸緩解。第二天改用頭孢類藥物加穿琥寧繼續治療,口服藥不變,體溫反覆時高達39℃,未再出現精神錯亂症狀,治療5d痊癒。錐體外系反應
張新春報導1例11歲患兒因支原體感染予紅黴素靜滴3d後改用乙硫異煙胺治療出現錐體外系反應,神志清,精神萎靡,皮膚無皮疹,頭後仰,雙目凝視,對光反射靈敏,心肺肝脾無異常,四肢肌張力升高。查體:T36.7℃,P92次/min,R30次/min。即停用乙硫異煙胺,肌肉注射東茛菪鹼及靜脈注射氟美松,1h後患兒錐體外系反應消失,頭顱CT、腦電圖檢查無異常,觀察2d無不適,繼用紅黴素治療至痊癒。
踝關節疼痛
王雪潔報導1例8歲患兒因支原體肺炎予乙硫異煙胺緩慢靜滴至第3d,滴完換滴維生素K1注射液時,患兒出現腳踝關節疼痛症狀,遂停用維生素K1注射液。但在第4d繼續輸注乙硫異煙胺時,患兒疼痛症狀加劇。隨後停用乙硫異煙胺注射液,並於次日改用紅黴素靜脈滴注,患兒自述再無踝關節疼痛症狀。
視物鏇轉、步態不穩
鄧益斌報導一4歲患兒因咳嗽半天自服乙硫異煙胺顆粒150mg(未服用其它藥物)約20min後出現頭暈、視物鏇轉、步態不穩,但無頭痛嘔吐、視物不清,無耳鳴及聲嘶,無腹痛腹瀉。查體除步態不穩外未見其他症狀體徵。該患兒半月前曾服用過同一盒藥,未出現任何不適。遂停用乙硫異煙胺,予大量飲水,靜脈滴注頭孢唑林、維生素C及補液治療,約6h後患兒頭暈及視物鏇轉消失,步態平穩。
盜汗
曹輝報導1例7歲患兒在靜脈滴注乙硫異煙胺的6d中,每日入睡後頸部均大汗淋漓,而軀幹及四肢未見出汗,直至治療結束停用乙硫異煙胺後,隨訪1周患兒未再出現盜汗,也無其他任何不適。
討論
通過對文獻進行分析,我們可以得出乙硫異煙胺在兒童及青少年引起的不良反應有下述幾個特點:
1、不良反應以6歲以下學齡前兒童為主,占60%以上,究其原因一方面與學齡前兒童生理、機能與成人差異較大有關,一方面也可能與學齡前兒童易患感染性疾病、乙硫異煙胺使用頻率較高有關;
2、不良反應出現時間較短,2h內出現者占一半以上,提示在用藥開始後,不論是靜脈給藥還是口服給藥,即需要密切觀察病人反應;
3、乙硫異煙胺引起不良反應經及時處理和搶救後致死率較低,但2歲以下嬰幼兒靜脈給藥時潛在危險較大,臨床給藥時應慎重選擇給藥方法,並需密切觀察;
4、仍有少數病例存在給藥劑量不當,給藥時應當引起注意;
5、乙硫異煙胺不良反應的類型呈多樣化,各臨床醫師一方面要多閱讀文獻和多思考,一方面應重視不良反應的病例報導特別是少見病例,以共同保障兒童用藥安全。
抗結核藥物分析
抗結核藥物具有肝臟毒性,處理不當,可危及病人的生命,因此正確認識抗結核藥物的肝毒性,並積極做好肝毒性的預防工作,是藥物控制結核病全球戰略中的一個重點。抗結核藥物單用時的肝毒性
1、異煙肼(雷米封):致肝毒性發病率約10%,多見於治療的第十周內。絕大多數病例停藥後肝功能可自行恢復;約1%的患者可發生症狀性肝炎,多發生在用藥的3個月內(短的一周,長的一年)。黃疸為基肝毒性的主要症狀,伴厭食、噁心和嘔吐的臨床表現,一般無發熱、關節痛的皮疹。異煙肼引起肝炎與其直接毒性相關,非免疫因素引起。近年研究證明異煙肼引起的肝炎是細胞色素P450介導所致毒性代謝物引起的。
2、利福平:為細胞色互素P4503A酶強力誘導劑,可致肝臟損害,主要致膽汁鬱積,與異煙肼聯用時肝毒性發病率增加。
3、乙胺丁醇:Gulliford等報導乙胺丁醇引起膽汁鬱積性肝炎一例,激發試驗陽性。乙胺丁醇致輕度肝損發病率為5%-37%,多見於用藥時間超過一個月的患教師)
4、吡嗪醯胺:主要副作用為肝臟毒性。早在50年代,推薦每日用量40-50毫克/公斤,致血清轉氨酶水平升高和症狀性肝炎,分別為20%和10%,甚至發生重症肝炎或死亡。由於吡嗪醯胺在痰中能快速殺滅結核桿菌,世界衛生組織重新將其列入標準抗結核方案,每日30毫克/公斤,連續使用兩個月比較安全。但高劑量(每天劑量大於30毫克/公斤)、長時間用藥致肝毒性發病率增高。
5、鏈黴素:致肝臟毒性少見。
6、氨硫脲:致輕度肝功能異常發病率為18%,少數病例可發生症狀性肝炎。
7、對氨基水楊酸鈉:致肝炎表現為肝細胞性、膽汁鬱積性或混合性。
8、喹諾酮類抗蓖藥:如氧氟沙星、司巴氟沙星和左氧氟沙星等,據報導致肝酶水平升高的發生率達20%-40%,少數病例出現症狀性(肝細胞性或膽汁鬱積性)肝炎。
9、其它藥物;乙硫異煙胺致血清轉氨酶水平平高的發生率為3%-56%,肝細胞黃疸發生率為2%-4%。捲曲黴素和環絲氨酸可致輕度肝酶升高,後者可致症狀性肝炎。丁胺卡那黴素和卡那黴素主要致腎毒性,很少引起肝毒性。
抗結核藥聯用時的肝毒性結核病患者常接受多種具有肝臟毒性抗結核藥物治療,其肝毒性發生率比單一用藥高,如異煙肼和利福平聯用較為常見,利福平致肝毒性較少,但與異煙肼聯用時肝功能導演明顯增加,異煙肼與利福平聯用發生血清轉氨酶升高的發病率為10%。兩藥聯用致肝炎發病率較高,且發生時間亦較早,異煙肼致肝損害多在用藥一個月之後,而兩藥合用則發生在15天之內。利福平為強力酶誘導劑,可誘導異煙肼代謝,從而加重異煙肼的肝毒生。利福平誘導細胞色素P450,增加異煙肼的無活性成分,從而可解釋利福平加重和加快異煙肼的肝臟毒性。此外,異煙肼與吡嗪醯胺合用也可致肝臟毒性發病率增加。急性肝功能衰竭的患者易發生藥物引起的腎臟毒性,而急性腎功能衰竭是急性肝功能衰竭的主要促發因素。因此,腎功能衰竭的患者用致肝毒性的抗結核藥物可能促發肝病。如鏈黴素具有腎毒性,是異煙肼或吡嗪醯胺引起重症肝炎的誘發因素之一。
英語說明
Ethionamide (Eto)
Ethionamide is part of a group of drugs used in the treatment of drug resistant TB called thioamides. It is used as part of treatment regimens, generally involving 5 medicines, to treat MDR and XDR TB. It was discovered in 1956.
Ethionamide is used as part of a South Africa’s standard regimen to treat MDR TB.
Dosage:
| Adults: | Adults with liver damage - creatine clearance < 30 ml/min: | Children: |
| 15,–,20,mg/kg,daily,(max,1000,mg) | 250,–,500, mg ,daily | 15,–,20,mg/kg,daily,(max,1000,mg) |
| Ethionamide is taken twice daily, generally one tablet (250 mg) in the daytime and 2 tablets (500 mg) at night . Ethionamide is taken during the intensive and continuation phases of treatment. |
How it works:
Ethionamide is an antibiotic used in the treatment of tuberculosis. The action may be through disruption of mycolic acid.
 乙硫異煙胺
乙硫異煙胺Ethionamide can cause persistent nausea and vomiting. Decreasing the dosage will decrease the symptoms, which is why ethionamide is taken twice a day. Ethionamide may also cause dizziness and fatigue. Occasionally ethionamide may cause jaundice (yellowing of the skin and eyes) or changes in mood (depression) and allergic reactions. Rarely, ethionamide will cause peripheral neuritis (tingling in the hands and feet) as well as vision disturbances.
It is recommended that ethionamide is avoided during pregnancy as it may increase nausea and vomiting. Ethionamide was shown to be teratogenic in animal studies.
Ethionamide should not be used in patients with severe liver disease or porphyria (a rare, inherited disease affecting the skin and nervous system). Blood sugar levels should be monitored in diabetic patients.
Clinical evidence and approval:
Ethionamide has received FDA approval for the treatment of tuberculosis in patients resistant or intolerant to other medications.
A prospective uncontrolled study of 39 patients published in 2006, found that regimens containing ethionamide appear to be safe and effective.1
Ethionamide is part of a group of second line agents used to treat drug resistant TB. The use of thioamides, including ethionamide and protionamide, is recommended before other second line agents (cycloserine or terizidone). There is complete cross resistance between ethionamide and protionamide.2
Evidence shows that strains that are resistant to low concentrations of isoniazid are probably susceptible to ethionamide and prothionamide. However, strains that are susceptible to high concentrations of isoniazid are usually resistant to ethionamide. The use of high-dose isoniazid and ethionamide increases the chance of successful treatment.3
Pricing (per lowest unit, i.e. single tablet or injection):
| SA Public sector (Aug 2009 – July 2011 tender) | |
| 250, mg | R1 ,71 |
| SA Public sector (August 2011 – July 2013 tender) | |
| 250, mg | R1 ,45 |
| SA,Private,sector | |
| 250, mg | R1 ,69 |
| Global, Drug ,Facility 4 | |
| 250, mg | R0,61, US$ ,0,09 |
* Private sector prices sourced on 26/07/11. Global Drug Facility prices converted to rands on 26/07/11.
* Private and public sector prices may vary between suppliers. The lowest available prices are shown here.
Advocacy issues:
Further research is needed on safety and efficacy for paediatric treatment. Paediatric formulations are not available. Further research is needed on potential interactions with antiretrovirals, including the potential increased risk of liver damage when combined with nevirapine and efavirenz. [MSF]
The SA public sector price is 2.8 x higher than available international prices.
Manufacturers and suppliers:
Today only two ethionamide products are quality-assured; one is prequalified by WHO (Macleods) and Pfizer has the marketing license for ethionamide in the US and Canada. Such a limited number of quality-approved sources means this product is relatively vulnerable to supply disruption.
The situation is likely to improve as a further two manufacturers (Lupin, Cipla) have submitted dossiers to WHO Prequalification and have been accepted for evaluation. The Cipla product has already been assessed by the Expert Review Panel for the GDF and the Global Fund and is currently listed as purchasable in 2011 with Global Fund money. An additional manufacturer (Micro Labs) is expected to submit during the course of 2011.
Additional manufacturers may exist in China, India, the former Soviet Union and other countries, but whether they comply with WHO quality standards is unknown.5

