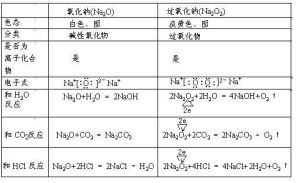
理化性質
物理性質
 分子式
分子式過氧化鈉還具有漂白性,原因是過氧化鈉與水反應過程中會生成H2O2,由於H2O2具有強氧化性,會將部分試劑如品紅等漂白,所以將過氧化鈉投入酚酞溶液中酚酞先變紅後褪色。
化學性質
過氧化鈉是離子化合物,其中氧元素顯-1價,鈉元素顯+1價,
以把過氧化鈉溶解在低溫的硫酸中,然後減壓蒸餾即可得到過氧化氫(H2O2):
過氧化鈉可與水、酸反應,生成氫氧化鈉和過氧化氫(過氧化氫會分解成水和氧氣),也能與二氧化碳反應生成碳酸鈉和氧氣。
過氧化鈉還能氧化一些金屬。例如,熔融的過氧化鈉能把鐵氧化成高鐵酸根;能將一些不溶於酸的礦石共熔使礦石分解。
在鹼性環境中,過氧化鈉可以把化合物中+3價的砷(As)氧化成+5價,把+3價的鉻(Cr)氧化成+6價。利用這個反應可以將某些岩石礦物中的+3價鉻除去。還可以在一般條件下將有機物氧化成乙醇和碳酸鹽,也可以與硫化物和氯化物發生劇烈反應。
常見反應
這裡需要特別說明的是,無論NO還是NO2都可以被過氧化鈉吸收,因此可用於吸收NO
所以,所有中學習題中所謂的NO,NO2,CO2混合氣體通過過氧化鈉後殘留NO或者NO2氣體的描述為錯誤的
過氧化鈉不屬於鹼性氧化物,屬於過氧化物,可與二氧化碳(與乾燥的二氧化碳不發生反應),酸反應,反應過程中均有氧氣放出,化學方程式分別為:
2Na2O2+2CO2=2Na2CO3+O2
過氧化鈉和水的反應首先產生過氧化氫,鹼性過氧化氫不穩定,會分解
Na2O2+2H2O=2NaOH+H2O2
2H2O2=2H2O+O2↑,反應放熱
總反應化學方程式:
2Na2O2+2H2O=4NaOH+O2↑
與次高價氣態非金屬氧化物能發生氧化還原反應,生成鹽,但不放出氧氣,直接化合如:
Na2O2+SO2=Na2SO4
與最高價氣態非金屬氧化物能發生氧化還原反應,生成鹽,放出氧氣,例:
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2SO3=2Na2SO4+O2
過氧化鈉和二氧化硫反應生成亞硫酸鈉和氧氣,亞硫酸鈉和氧氣反應生成硫酸鈉
反應方程式:
2Na2O2+2SO2=2Na2SO3+O2
2Na2SO3+O2=2Na2SO4
所以Na2O2+SO2=Na2SO4
另外,過氧化鈉可以將鐵單質氧化成含FeO4-的鐵酸鹽,還可以在一般條件下將有機物氧化成乙醇和碳酸鹽。,也可以與硫化物和氯化物發生劇烈反應。
過氧化鈉的熱穩定性好,可加熱到熔融狀態而不分解。
此外,過氧化鈉還可以與鈉反應,方程式為:
Na2O2+2Na=2Na2O
製備方法
方法一
工業上製備過氧化鈉的方法是將鈉加熱至熔化,通入一定量的除去二氧化碳的乾燥空氣,維持溫度在453-473K之間,鈉即被氧化為氧化鈉,進而增加空氣流量並迅速提高溫度至573-673K,即可製得過氧化鈉。
其化學反應方程式為:
4Na+O2=2Na2O
2Na2O+O2=2Na2O2[2]
方法二
純淨的Na2O2·8H2O是用飽和NaOH(純級)溶液與42%H2O2混合製得:
2NaOH+H2O2→Na2O2+2H2O(0℃)
物質用途
可做供氧劑,強氧化劑,具有漂白性。
1.它能與CO2作用,放出O2。
2Na2O2+2CO2=2Na2CO3+O2
根據這個性質,可將它用在礦山、坑道、潛水或宇宙飛船等缺氧的場合,將人們呼出的CO2再轉換成O2,以供呼吸之用。
2.過氧化鈉可用來除去O2中的H2O和CO2雜質。
3.過氧化鈉還可以用於消毒、殺菌和漂白等,在工業上常用做漂白劑、殺菌劑、消毒劑、去臭劑、氧化劑等。
4.熔融態的過氧化鈉是非常好的氧化劑,可以把Fe氧化為高鐵酸根,甚至可以在常溫下把有機物轉化為碳酸鹽。
可用於制過氧化氫,過程如下。
①用磷酸或磷酸二氫鈉將過氧化鈉水溶液中和至PH:9.0~9.7,使生成磷酸氫鈉和過氧化氫的水溶液。
②使所說的磷酸氫鈉和過氧化氫水溶液冷卻到+5~-5℃,從而使絕大部分磷酸氫鈉以十水磷酸氫鈉水合物形式析出。
③在離心分離器中對含有磷酸氫鈉水合物和過氧化氫水溶液混合物進行分離,從而使磷酸氫鈉水合物結晶從含少量磷酸氫鈉的過氧化氫水溶液中分離出來。
④將所說的含少量磷酸氫鈉的過氧化氫水溶液在蒸發器中蒸發,得到含過氧化氫和水的蒸汽,而含過氧化氫的磷酸氫鈉濃鹽溶液從底部流出並返回中和槽。
⑤將所說的含過氧化氫和水的蒸汽在分餾塔中進行減壓分餾,得到約30%過氧化氫。
其水溶液可用作漂白劑(脫色劑),氧化劑,防腐劑,殺菌劑,除臭劑,微量分析。
安全相關
過氧化鈉具有強氧化性,在熔融狀態時遇到棉花、炭粉、鋁粉等還原性物質會發生爆炸。因此存放時應注意安全,不能與易燃物接觸。它易吸潮,有強腐蝕性,會引起燒傷。
常見謠言
謠言:把少量NO2氣體通入過量小蘇打溶液中,再使溢出的氣體通過裝有足量的過氧化鈉顆粒的乾燥管,最後收集到的氣體是A.氧氣B.二氧化氮C.二氧化氮和氧氣D.二氧化氮和一氧化氮
駁斥:這種所謂習題存在根本性的科學錯誤,NO、NO2均能與Na2O2直接反應而不會有殘留,因此不可能出現通過過氧化鈉充分吸收後殘留一氧化氮或二氧化氮的情況,只可能殘留氧氣O2,然而又因為存在如下反應
2NO+O2=2NO2(注意這與過氧化鈉直接吸收NO的反應互相競爭,總反應可以看成2NO+O2+Na2O2=2NaNO3),形成的二氧化氮又可以被過氧化鈉繼續吸收。所以實際上的情況是氣體全部被吸收或者只剩餘氧氣,並且由於兩個反應競爭性的進行,無法進行定量分析與討論。

