簡介
活性中間體 在有機反應中,反應物分子往往先形成碳正離子、碳負離子、游離基、碳烯等活性大、壽命短的中間體,稱為活性中間體。活性中間體一般都能迅速變成反應產物。活性中間體在常溫下一般不易分離和檢驗,但通過動力學等研究手段可推測其存在。有些則可在特殊的實驗條件下,進行分離和檢驗。在有機反應歷程的研究中,需要說明反應物如何變成活性中間體,活性中間體又如何變成產物。因而活性中間體的確定是有機反應歷程研究中的重要環節。
對於極性反應,其活性中間體往往是正離子或負離子。而對於自由基反應,其活性中間體為自由基。同環反應沒有活性中間體活性中間體產生和存在的最主要因素就是分子的結構,活性中間體能穩定存在是其容易生成的先決條件,而活性中問體穩定存在的主要原因是電荷的分散程度。
反應過程
有機反應一般涉及共價鍵的斷裂和形成兩個歷程,其方式有同時發生協同反應和分階段進行兩種。多數有機反應是分階段進行的,過程中出現的活潑反應中間體(A和B),再進一步反應生成最終的穩定產物(A-C):
 活性中間體
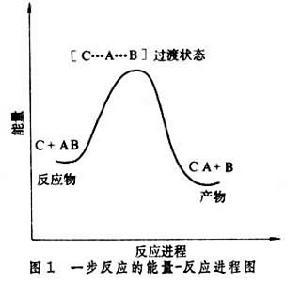
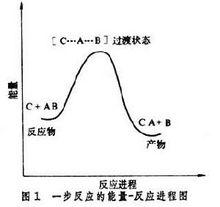
活性中間體一步反應: C+A-B→【C…A…B】→C-A+B
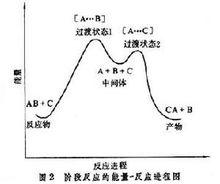
階段反應: A-B→【A…B】→A+B
A+C→【A…C】→C-A
協同反應是一步完成的,沒有反應中間體,所以只經歷一個過渡狀態(圖1)。
而階段反應(圖2),從反應物到產物,要經過兩個高點和一個低點,這個低點就代表活性中間體。其能量較反應物和產物均高得多,所以很活潑,但是相對於兩個高點(過渡狀態1和2)能量又較低,因而能短暫存在。中間體的能量勢谷(即圖中最低點)越低,就越穩定,壽命也越長。
 活性中間體
活性中間體迄今已發現多種各具特色的反應活性中間體。主要有:正碳離子(R+)、負碳離子(R )、自由基(R·)、卡賓(RC:)。還有複合型中間體,如正離子基R 和負離子基R (見離子基)等物種。
中間體極其活潑,壽命很短,難以用常規方法加以分離和提純。鑒於它們的結構特徵,可以在特殊條件(低溫或捕集、絡合等)下使用現代光譜學及其他化學或物理學的手段來鑑別其結構和反應性能。
碳正離子
碳正離子可以由鹵代烷烴或含氧無機酸酯異裂而產生,其穩定性次序為三級>二級>一級。
有些碳正離子已分離出來並由光譜證實:
 活性中間體
活性中間體前述碳正離子(除䓬離子外)均為sp 雜化狀態的經典碳正離子。而由於π鍵、σ鍵或鄰基參與而形成的碳正離子,它是在一定範圍內發生離域化而形成的共振雜化體,此類碳正離子稱為非經典碳正離子,如:
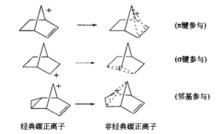 活性中間體
活性中間體由於非經典碳正離子的電荷得到了分散,因而比相應的經典正碳離子更加穩定。當親核試劑進攻時,它可以進攻非經典碳正離子的任何一個可能的區域。
碳正離子的穩定性有其規律:凡與共軛體系相連的碳正離子總比非共軛體系更穩定,因而也更容易產生。然而分散了正電荷的非經典碳正離子的親電活性較經典碳正離子有所降低。
碳負離子
碳負離子可以通過金屬有機化合物(如RLi、RMgX、RC一CNa等)異裂而產生,也可以通過C—H鍵的碳原子上有吸電基時與鹼(以B:表示)作用生成。如:
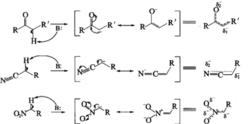 活性中間體
活性中間體與共軛體系相連並形成共振異構體。由此不難看出:
負電荷被分散了,因而比較穩定;具有部分負電荷的質點不止一個,而這些帶有部分負電荷的質點都具有親核性。共軛體系的存在可使碳負離子的電荷得到分散,因而使碳負離子更穩定,也更容易生成。與碳正離子不同的是,分散了負電荷的共軛體系並未降低碳負離子的親核活性,原因是其可極化度增加的緣故。
自由基
自由基反應與極性反應、同環反應並列為三種主要化學反應機理。自由基是具有未成對電子的順磁性物質,可以產生電子自旋共振譜,因此一般用電子自旋共振譜(ESR)來檢測自由基,也可用自由基捕捉劑(spin trap)、核磁共振譜和自由基抑制劑來檢測自由基。
自由基反應機理包括三步:引發、傳遞和終止。自由基反應的速率取決於自由基濃度,而自由基濃度主要取決於引發劑的濃度,在動力學上為一級半反應。大多數有機化合物在高溫下可以均裂產生自由基,自由基產生難易取決於其離解能,而離解能的大小與分子結構有關:
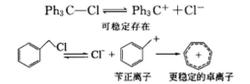
1、與共軛體系相連的自由基比較穩定,因而有利於生成。如苄基自由基、烯丙基自由基易於生成。
2、支鏈越多,自由基越穩定,越容易生成。如烷基自由基穩定性為叔碳>仲碳>伯碳。
3、鍵長越長,原子問電負性差越小,則自由基越容易生成。如N、O、S、P等雜原子之間的單鍵一般鍵能較低。
總而言之,根據分子的結構,特別是共軛性和電荷分散性的特點,可判斷活性中間體的穩定性和生成難易。同樣,根據活性中間體的電荷分布狀態可判斷其不同機理的化學反應活性。