成份
 阿貝他
阿貝他本品主要成份為苯扎貝特。
化學名稱:[對-4-氯苯甲醯-β-氨乙基苯氧]異丁酸
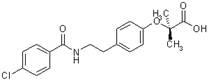
化學結構式:
分子式:CH0ClNO
分子量:361.82
性狀
本品為薄膜衣片,除去包衣後顯白色或類白色。
適應症
用於治療高甘油三酯血症、高膽固醇血症、混合型高脂血症。
規格
0.2g
用法用量
成人常用量:
口服苯扎貝特片每日3次,每次200-400mg。可在飯後或與飯同服。療效佳者維持量可為每日2次,每次400mg。腎功能障礙時按肌酐清除率調整劑量:40-60ml/min時,每日2次,每次400mg;15-40ml/min時,每日或隔日1次,每次400mg;低於15ml/min時,每3日1次,每次400mg。
不良反應
1.最常見的不良反應為胃腸道不適,如消化不良、厭食、噁心、嘔吐、飽脹感、胃部不適等,其它較少見的不良反應還有頭痛、頭暈、乏力、皮疹、瘙癢、陽萎、貧血及白細胞計數減少等。
2.偶有膽石症或肌炎(肌痛、乏力)。本品屬氯貝丁酸衍生物,有可能引起肌炎、肌病和橫紋肌溶解綜合徵,導致血肌酸磷酸激酶升高。發生橫紋肌溶解,主要表現為肌痛合併血肌酸磷酸激酶升高、肌紅蛋白尿,並可導致腎衰,但較罕見。在患有腎病綜合徵及其它腎損害而導致血白蛋白減少的患者或甲狀腺機能亢進的患者,發生肌病的危險性增加。
3.偶有血氨基轉移酶增高。
禁忌
1.對苯扎貝特過敏者禁用。
2.患膽囊疾病、膽石症者禁用,本品有可能使膽囊疾患症狀加劇。
3.肝功能不全或原發性膽汁性肝硬化的患者禁用。
4.嚴重腎功能不全患者禁用,因為在腎功不全的患者服用本品有可能導致橫紋肌溶解和嚴重高血鉀;腎病綜合徵引起血白蛋白減少的患者禁用,因其發生肌病的危險性增加。
注意事項
1.本品對診斷有干擾:
①血紅蛋白、白細胞計數可能減低;
②血氨基轉移酶可能增高;
③血肌酐升高。
2.用藥期間應定期檢查:
①全血象及血小板計數;
②肝腎功能試驗;
③血脂;
④血肌酸磷酸激酶。
3.如用藥後臨床上出現膽石症、肝功能顯著異常、可疑的肌病的症狀(如肌痛、觸痛、乏力等)或血肌酸磷酸激酶顯著升高,則應停藥。
4.在治療高血脂的同時,還需關注和治療可引起高血脂的各種原發病,如甲狀腺機能減退、糖尿病等。某些藥物也可引起高血脂,如雌激素、噻嗪類利尿藥和β阻滯劑等,停藥後,則不再需要相應的抗高血脂治療。
5.飲食療法始終是治療高血脂的首要方法,加上鍛鍊和減輕體重等方式,都將優於任何形式的藥物治療。
孕婦及哺乳期婦女用藥
本品在妊娠期的安全性未確立,故孕婦不推薦使用。本品是否分泌進入乳汁不詳,故哺乳期婦女不宜服用。
兒童用藥
兒童服用本品的療效及安全性,目前尚無實驗研究加以證實,故不宜套用。
老年用藥
老年人應根據肝腎功能狀態調節用藥劑量。如有腎功能不良時,須適當減少本品用藥量。
藥物相互作用
1.本品可明顯增強口服抗凝藥的作用,與其同用時應注意降低口服抗凝藥的劑量,經常監測凝血酶原時間以調整抗凝藥劑量。其作用機制尚不確定,可能是因為本品能將華法林等從其蛋白結合位點上替換出來,從而使其作用加強。
2.本品與其它高蛋白結合率的藥物合用時,也可將它們從蛋白結合位點上替換下來,導致其作用加強,如甲苯磺丁脲及其它磺脲類降糖藥、苯妥英、呋塞米等,在降血脂治療期間服用上述藥物,則應調整降糖藥及其它藥的劑量。
3.氯貝丁酸衍生物與HMG-CoA還原酶抑制劑,如洛伐他汀等合用治療高脂血症,將增加兩者嚴重肌肉毒性發生的危險,可引起肌痛、橫紋肌溶解、血肌酸磷酸激酶增高等肌病,應儘量避免聯合使用。
4.本品主要經腎排泄,在與免疫抑制劑,如環孢素合用時,可增加後者的血藥濃度和腎毒性,有導致腎功能惡化的危險,應減量或停藥。本品與其它有腎毒性的藥物合用時也應注意。
5.本品能增加降糖藥的作用。
藥物過量
目前尚無有關本品藥物過量的報導,如發生藥物過量,應針對中毒症狀採取相應支持療法。
藥理毒理
本品為氯貝丁酸衍生物類血脂調節藥。其降血脂作用有兩種機制,一是本品增高脂蛋白脂酶和肝脂酶活性,促進極低密度脂蛋白的分解代謝,使血甘油三酯的水平降低。其次是本品使極低密度脂蛋白的分泌減少。本品降低血低密度脂蛋白和膽固醇,可能通過加強對受體結合的低密度脂蛋白的清除。本品降低血甘油三酯的作用比降低血膽固醇為強,也使高密度脂蛋白升高。此外本品尚可降低血纖維蛋白原。已有的研究未發現本品有致癌、致突變作用。
藥代動力學
本品口服後吸收迅速,接近完全。口服後2小時血藥濃度達峰值。本品血漿蛋白結合率為95%。主要經腎排出,50%為原形,其餘為代謝產物;少量經大便排出。T1/2為1.5~2小時,在腎病腹膜透析病人可長達20小時。
貯藏
密封保存。
包裝
鋁鋁包裝,10片/板,2板/盒。
有效期
24個月
執行標準
《中國藥典》2010年版二部
批准文號
國藥準字H20010013
生產企業
江蘇天士力帝益藥業有限公司
核准日期
2007年07月25日
修訂日期
2009年6月24日 2010年10月01日
