雙酶切
 雙酶切
雙酶切同步雙酶切是一種省時省力的常用方法。選擇能讓兩種酶同時作用的最佳緩衝液是非常重要的一步。NEB每一種酶都隨酶提供相應的最佳NEBuffer,以保證100%的酶活性。NEBuffer的組成及內切酶在不同緩衝液中的活性見《內切酶在不同緩衝液里的活性表》及每支酶的說明書。能在最大程度上保證兩種酶活性的緩衝液即可用於雙酶切。由於內切酶在非最佳緩衝液條件下的切割速率會減緩,因此使用時可根據每種酶在非最優緩沖液中的具體活性相應調整酶量和反應時間。
2、分步酶切
如果找不到一種可以同時適合兩種酶的緩衝液,就只能採用分步酶切。分步酶切應從反應要求鹽濃度低的酶開始,酶切完畢後再調整鹽濃度直至滿足第二種酶的要求,然後加入第二種酶完成雙酶切反應。
3、使用配有特殊緩衝液的酶進行雙酶切
使用配有特殊緩衝液的酶進行雙酶切也不複雜。在大多數情況下,採用標準緩衝液的酶也能在這些特殊緩衝液中進行酶切。這保證了對緩衝液有特殊要求的酶也能良好工作。由於內切酶在非最佳緩衝液中進行酶切反應時,反應速度會減緩,因此需要增加酶量或延長反應時間。通過《內切酶在不同緩衝液里的活性表》可查看第二種酶在特殊緩衝液相應鹽濃度下的作用活性。
限制性內切酶
 PCR產物的NcoI限制性內切酶酶切鑑定
PCR產物的NcoI限制性內切酶酶切鑑定5'…G↓AATTC…3'→5'…GAATTC…3'
3'…CTTAA↑G…5'→3'…CTTAAG…5'
DNA純度、緩衝液、溫度條件及限制性內切酶本身都會影響限制性內切酶的活性。大部分限制性內切酶不受RNA或單鏈DNA的影響。當微量的污染物進入限制性內切酶貯存液中時,會影響其進一步使用,因此在吸取限制性內切酶時,每次都要用新的吸管頭。如果採用兩種限制性內切酶,必須要注意分別提供各自的最適鹽濃度。若兩者可用同一緩衝液,則可同時水解。若需要不同的鹽濃度,則低鹽濃度的限制性內切酶必須首先使用,隨後調節鹽濃度,再用高鹽濃度的限制性內切酶水解。也可在第一個酶切反應完成後,用等體積酚/氯仿抽提,加0.1倍體積3mol/LNaAc和2倍體積無水乙醇,混勻後置-70℃低溫冰櫃30分鐘,離心、乾燥並重新溶於緩衝液後進行第二個酶切反應。
酶切實驗
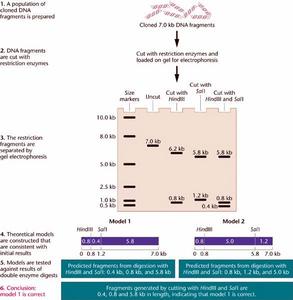 酶切技術
酶切技術1.掌握限制性核酸內切酶消化DNA的原理。
2.掌握重組質粒DNA的酶切鑑定方法。
3.掌握瓊脂糖凝膠電泳分析酶切結果。
基本原理
限制性核酸內切酶是一類能識別雙鏈DNA中特定鹼基順序的核酸水解酶(水解磷酸二酯鍵)。根據酶的識別切割特性、催化條件及是否具有修飾酶活性,可分為Ⅰ、Ⅱ、Ⅲ型三大類。通常所指的DNA限制性核酸內切酶就是Ⅱ型酶。
主要試劑
重組質粒DNA插入片段300bp
本實驗所用限制性核酸內切酶為EcoRⅠ,其識別順序為:
5′----G↓AATTC----3′
3′----CTTAA↑G----5′
磷酸二脂鍵斷裂產生5′粘性末端。
操作步驟
1.反應體系的建立:
⑴在一無菌1.5mlEppendorf管中加入:
無菌雙蒸水7μl
10×酶切緩衝液2μl
質粒DNA(100ng/μl)10μl
EcoRⅠ(5U/μl)1μl
總體積為20μl
⑵輕輕混勻,12000rpm離心5sec。
2.37℃水浴1h。
3.將Eppendorf管置65℃水浴中10min,通過加熱使酶失活以終止反應。
4.12000rpm離心5sec,將管蓋及管壁上的水離下。
 酶切技術
酶切技術6結果觀察。
操作注意事項:
1.吸樣量一定要準確
2.為了不使酶污染而導致浪費,最後才加酶
3.要求在冰上操作,並充分混勻,
4.開啟Eppendorf管時,手不要接觸到管蓋內面,以防污染。
5.樣品在37℃與65℃保溫時,將離心管蓋嚴,以防水進入管內造成實驗失敗。
限制性內切酶酶解中常見的問題和原因
1.DNA完全沒有被限制性內切酶切割:①限制性內切酶失活;②DNA不純,含有SDS、有機溶劑、EDTA等;③非限制性內切酶最佳反應條件;④酶切位點被修飾;⑤DNA上不存在該酶的識別順序。
2.DNA切割不完全:①限制性內切酶活性下降或稀釋不正確;②DNA不純或反應條件不佳;③酶切位點被修飾;④部分DNA溶液粘在管壁上;⑤酶切後DNA粘末端退火。
3.DNA片段數目多於理論值:①限制性內切酶星號活力;②存在第二種限制性內切酶污染;③樣品DNA中含有其它DNA。
技術問題
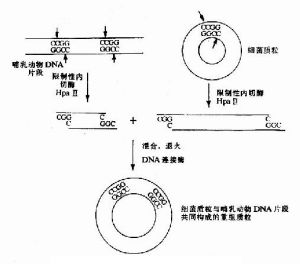 同一限制酶切割DNA粘性末端的連線
同一限制酶切割DNA粘性末端的連線雙酶切時間及其體系:酶切過夜,其實完全沒有必要,一般酶切3個小時,其實1個小時已經足夠。套用大體系,如100微升。
純化問題:純化PCR產物割膠還是柱式,優選柱式,因為割膠手法不準,很容易割下大塊的膠,影響純化效率。現在的柱式純化號稱可以祛除引物,既然如此,酶切掉的幾個鹼基肯定也會被純化掉了。所以,PCR產物和雙酶切產物的純化均可套用柱式純化。優選TAKARA的純化柱試劑盒。
酶量的問題:以TAKARA的為例,其對1單位酶的定義如下:在50μl反應液中,30℃溫度下反應1小時,將1μg的λDNA完全分解的酶量定義為1個活性單位(U)。而該酶濃度約為15單位/微升,在除外酶降解的因素外,該酶可分解15μg的DNA,而一般從1-4ml菌液提出的DNA約為3μg,而PCR純化後的產物(50體系)約為3μg,所以即便全部加進去,只要純化的質量好,酶切完全切得動。
2、酶切、回收後的PCR產物與載體的連線
摩爾比的計算,回收的載體片段:回收的PCR產物片段=1:10 ,一般取前者0.03pmol,後者取0.3pmol。
pmol為單位的DNA轉換為為μg單位的DNA:(Xpmoles×長度bp×650)/1,000,000(註:長度bp×650是該雙鏈DNA的分子量)所得數值即為μg,也可以直接用這個公式套.1pmol1000bpDNA=0.66μg,如載體是5380bp,則0.03pmol為0.03×5.38×0.66=0.106524μg。
測DNA濃度可以在專用機子上測,注意OD值,一般約1.8-2.0.另外,如果嫌麻煩,也可用MARKER進行估測,如MARKER2000,5微升的MARKER每個條帶約50ng。
連線反應:TAKARA的連線酶上的說明寫的過夜,而其對連線酶單位的定義為:在20μl的連線反應體系中,6μg的λDNA-HindIII的分解物在16℃下反應30分鐘時,有90%以上的DNA片段被連線所需要的酶量定義為1個活性單位(U)。而它的濃度為350U/μl,所以完全夠用。連線酶容易失活,注意低溫操作。時間3個小時足已。
3、轉化:
a、全量(10μl)加入至100μlJM109感受態細胞中,冰中放置30分鐘。
b、42℃加熱45秒鐘後,再在冰中放置1分鐘。
c、加入890μlAMP陰性培養基,37℃振盪培養60分鐘。
取100μl鋪板。也可離心後餘100μl。
