概述
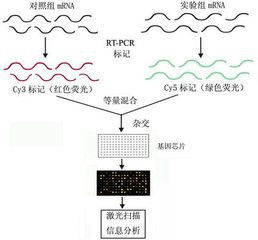
 基因晶片原理圖
基因晶片原理圖基因晶片(genechip)的原型是80年代中期提出的。基因晶片的測序原理是雜交測序方法,即通過與一組已知序列的核酸探針雜交進行核酸序列測定的方法,可以用圖11-5-1來說明。在一塊基片表面固定了序列已知的八核苷酸的探針。當溶液中帶有螢光標記的核酸序列TATGCAATCTAG,與基因晶片上對應位置的核酸探針產生互補匹配時,通過確定螢光強度最強的探針位置,獲得一組序列完全互補的探針序列。據此可重組出靶核酸的序列。
基因晶片又稱為DNA微陣列(DNAmicroarray),可分為三種主要類型:1)固定在聚合物基片(尼龍膜,硝酸纖維膜等)表面上的核酸探針或cDNA片段,通常用同位素標記的靶基因與其雜交,通過放射顯影技術進行檢測。這種方法的優點是所需檢測設備與目前分子生物學所用的放射顯影技術相一致,相對比較成熟。但晶片上探針密度不高,樣品和試劑的需求量大,定量檢測存在較多問題。2)用點樣法固定在玻璃板上的DNA探針陣列,通過與螢光標記的靶基因雜交進行檢測。這種方法點陣密度可有較大的提高,各個探針在表面上的結合量也比較一致,但在標準化和批量化生產方面仍有不易克服的困難。3)在玻璃等硬質表面上直接合成的寡核苷酸探針陣列,與螢光標記的靶基因雜交進行檢測。該方法把微電子光刻技術與DNA化學合成技術相結合,可以使基因晶片的探針密度大大提高,減少試劑的用量,實現標準化和批量化大規模生產,有著十分重要的發展潛力。
它是在基因探針的基礎上研製出的,所謂基因探針只是一段人工合成的鹼基序列,在探針上連線一些可檢測的物質,根據鹼基互補的原理,利用基因探針到基因混合物中識別特定基因。它將大量探針分子固定於支持物上,然後與標記的樣品進行雜交,通過檢測雜交信號的強度及分布來進行分析。基因晶片通過套用平面微細加工技術和超分子自組裝技術,把大量分子檢測單元集成在一個微小的固體基片表面,可同時對大量的核酸和蛋白質等生物分子實現高效、快速、低成本的檢測和分析。
由於尚未形成主流技術,生物晶片的形式非常多,以基質材料分,有尼龍膜、玻璃片、塑膠、矽膠晶片、微型磁珠等;以所檢測的生物信號種類分,有核酸、蛋白質、生物組織碎片甚至完整的活細胞;按工作原理分類,有雜交型、合成型、連線型、親和識別型等。由於生物晶片概念是隨著人類基因組的發展一起建立起來的,所以至今為止生物信號平行分析最成功的形式是以一種尼龍膜為基質的“cDNA陣列”,用於檢測生物樣品中基因表達譜的改變。
簡介
 基因晶片
基因晶片它的出現為解決此類問題提供了光輝的前景。該技術系指將大量(通常每平方厘米點陣密度高於 400 )探針分子固定於支持物上後與標記的樣品分子進行雜交,通過檢測每個探針分子的雜交信號強度進而獲取樣品分子的數量和序列信息。早在八十年代, Bains W. 等人 就將短的 DNA 片斷固定到支持物上,藉助雜交方式進行序列測定。但基因晶片從實驗室走向工業化卻是直接得益於探針固相原位合成技術和照相平板印刷技術的有機結合以及雷射共聚焦顯微技術的引入。它使得合成、固定高密度的數以萬計的探針分子切實可行,而且藉助雷射共聚焦顯微掃描技術使得可以對雜交信號進行實時、靈敏、準確的檢測和分析。
基本原理
 基因晶片共焦掃瞄器
基因晶片共焦掃瞄器基因晶片又稱為DNA微陣列(DNA microarray),可分為三種主要類型:1)固定在聚合物基片(尼龍膜,硝酸纖維膜等)表面上的核酸探針或cDNA片段,通常用同位素標記的靶基因與其雜交,通過放射顯影技術進行檢測。這種方法的優點是所需檢測設備與目前分子生物學所用的放射顯影技術相一致,相對比較成熟。但晶片上探針密度不高,樣品和試劑的需求量大,定量檢測存在較多問題。2)用點樣法固定在玻璃板上的DNA探針陣列,通過與螢光標記的靶基因雜交進行檢測。這種方法點陣密度可有較大的提高,各個探針在表面上的結合量也比較一致,但在標準化和批量化生產方面仍有不易克服的困難。3)在玻璃等硬質表面上直接合成的寡核苷酸探針陣列,與螢光標記的靶基因雜交進行檢測。該方法把微電子光刻技術與DNA化學合成技術相結合,可以使基因晶片的探針密度大大提高,減少試劑的用量,實現標準化和批量化大規模生產,有著十分重要的發展潛力。
它是在基因探針的基礎上研製出的,所謂基因探針只是一段人工合成的鹼基序列,在探針上連線一些可檢測的物質,根據鹼基互補的原理,利用基因探針到基因混合物中識別特定基因。它將大量探針分子固定於支持物上,然後與標記的樣品進行雜交,通過檢測雜交信號的強度及分布來進行分析。基因晶片通過套用平面微細加工技術和超分子自組裝技術,把大量分子檢測單元集成在一個微小的固體基片表面,可同時對大量的核酸和蛋白質等生物分子實現高效、快速、低成本的檢測和分析。
由於尚未形成主流技術,生物晶片的形式非常多,以基質材料分,有尼龍膜、玻璃片、塑膠、矽膠晶片、微型磁珠等;以所檢測的生物信號種類分,有核酸、蛋白質、生物組織碎片甚至完整的活細胞;按工作原理分類,有雜交型、合成型、連線型、親和識別型等。由於生物晶片概念是隨著人類基因組的發展一起建立起來的,所以至今為止生物信號平行分析最成功的形式是以一種尼龍膜為基質的“cDNA陣列”,用於檢測生物樣品中基因表達譜的改變。
主要類型
 基因晶片檢測
基因晶片檢測原位合成法主要為光引導聚合技術( Light-directed synthesis ),它不僅可用於寡聚核苷酸的合成,也可用於合成寡肽分子。光引導聚合技術是照相平板印刷技術( photolithography )與傳統的核酸、多肽固相合成技術相結合的產物。半導體技術中曾使用照相平板技術法在半導體矽片上製作微型電子線路。固相合成技術是當前多肽、核酸人工合成中普遍使用的方法,技術成熟且已實現自動化。二者的結合為合成高密度核酸探針及短肽陣列提供了一條快捷的途徑。
以合成寡核苷酸探針為例,該技術主要步驟為:首先使支持物羥基化,並用光敏保護基團將其保護起來。每次選取擇適當的蔽光膜( mask )使需要聚合的部位透光,其它部們不透光。這樣,光通過蔽光膜照射到支持物上,受光部位的羥基解保護。因為合成所用的單體分子一端按傳統固相合成方法活化,另一端受光敏保護基的保護,所以發生偶聯的部位反應後仍舊帶有光敏保護基團。因此,每次通過控制蔽光膜的圖案(透光與不透光)決定哪些區域應被活化,以及所用單體的種類和反應次序就可以實現在待定位點合成大量預定序列寡聚體的目的。
該方法的主要優點是可以用很少的步驟合成極其大量的探針陣列。例如,合成 48 ( 65536 ) 個探針的 8 聚體寡核苷酸序列僅需 4 × 8=32 步操作, 8 小時就可以完成。而如果用傳統方法合成然後點樣,那么工作量的巨大將是不可思議的。同時,用該方法合成的探針陣列密度可高達到 106/cm2 。不過,儘管該方法看來比較簡單,實際上並非如此。主要原因是,合成反應每步產率比較低,不到 95% 。而通常固相合成反應每步的產率在 99% 以上。因此,探針的長度受到了限制。而且由於每步去保護不很徹底,致使雜交信號比較模糊,信噪比降低。為此有人將光引導合成技術與半異體工業所用的光敏抗蝕技術相結合,以酸作為去保護劑,使每步產率增加到 98% 。原因是光敏抗蝕劑的解離對照度的依賴是非線性的,當照度達到特定的閾值以上保護劑就會解離。所以,該方法同時也解決了由於蔽光膜透光孔間距離縮小而引起的光衍射問題,有效地提高了聚合點陣的密度。另據報導 ,利用波長更短的物質波如電子射線去除保護可使點陣密度達到 1010/cm2 。
除了光引導原位合成技術外,有的公司如美國 Incyte Pharmaceuticals 等使用壓電列印法 (Piezoelectric printing) 進行原位合成。其裝置與普通的彩色噴墨印表機並無兩樣,所用技術也是常規的固相合成方法。做法是將墨盒中的墨汁分別用四種鹼基合成試劑所替代,支持物經過包被後,通過計算機控制噴墨印表機將特定種類的試劑噴灑到預定的區域上。沖洗、去保護、偶聯等則同於一般的固相原位合成技術。如此類推,可以合成出長度為 40 到 50 個鹼基的探針,每步產率也較前述方法為高,可達到 99% 以上。
儘管如此,通常原位合成方法仍然比較複雜,除了在基因晶片研究方面享有盛譽的 Affymetrix 等公司使用該技術合成探針外,其它中小型公司大多使用合成點樣法。
後一方法在多聚物的設計方面與前者相似,合成工作用傳統的 DNA 或多肽固相合成儀完成,只是合成後用特殊的自動化微量點樣裝置將其以比較高的密度塗布於硝酸纖維膜、尼龍膜或玻片上。支持物應事先進行特定處理,例如包被以帶正電荷的多聚賴酸或氨基矽烷。現在已有比較成型的點樣裝置出售,如美國 Biodot 公司的點膜產品以及 Cartesian Technologies 公司的 PixSys NQ/PA 系列產品。前者產生的點陣密度可以達到 400/cm2 ,後者則可達到 2500/cm2 。
發展歷史
 基因晶片
基因晶片搶先發展技術,儘快占領市場是市場經濟競爭中取得勝利的信條。生物晶片目前正處於激烈的技術競爭狀態中。Packard儀器公司發展的是診斷用的以凝膠為基礎的中等密度的晶片。而Affymetrix公司則已成功地套用了光導向平板印刷技術直接在矽片上合成寡核苷酸點陣的高密度晶片而領先於晶片分析領域。該公司與惠普公司合作開發出專用的能掃描40萬點點陣的基因晶片掃瞄器,同時又開發出同時可平行通過幾塊晶片的流路工作站和計算機軟體分析系統。組合成一套較完整的晶片製造、雜交、檢測掃描和數據處理系統。不久GenralScanningInc與製造點樣頭的Telechem公司和製造機械手的Cartesian公司研製的300型(兩雷射)4000型和5000型(四雷射)雷射共聚掃瞄器和相應的分析軟體,構成一套用戶可任意點樣製作晶片的工作系統。
歐洲各公司也不甘落後,紛紛投入競爭,例如GeneticCo.UK研製出QBot點樣器,Q-Pix克隆挑揀儀及Q-Fill制晶片設備。Sequenom則推出250位點的Spectrochip並採用質譜法測讀結果,而德國腫瘤研究所則用就位合成的肽核酸低密度(8cm×12cm片上1000個點)的作表達譜及診斷用的探針晶片。如今,DNA晶片已經在基因序列分析、基因診斷、基因表達研究、基因組研究、發現新基因及各種病原體的診斷等生物醫學領域表現出巨大的套用前景。
相關技術
樣品的準備及雜交檢測
目前,由於靈敏度所限,多數方法需要在標記和分析前對樣品進行適當程式的擴增,不過也有不少人試圖繞過這一問題,如 Mosaic Technologies 公司引入的固相 PCR 方法,引物特異性強,無交叉污染並且省去了液相處理的煩瑣; Lynx Therapeutics 公司引入的大規模並行固相克隆法 (Massively parallel solid-phase cloning) ,可在一個樣品中同時對數以萬計的 DNA 片段進行克隆,且無需單獨處理和分離每個克隆。
顯色和分析測定方法主要為螢光法,其重複性較好,不足的是靈敏度仍較低。目前正在發展的方法有質譜法、化學發光法、光導纖維法等。以螢光法為例,當前主要的檢測手段是雷射共聚焦顯微掃描技術,以便於對高密度探針陣列每個位點的螢光強度進行定量分析。因為探針與樣品完全正常配對時所產生的螢光信號強度是具有單個或兩個錯配鹼基探針的 5-35 倍,所以對螢光信號強度精確測定是實現檢測特異性的基礎 [8] 。但螢光法存在的問題是,只要標記的樣品結合到探針陣列上後就會發出陽性信號,這種結合是否為正常配對,或正常配對與錯配兼而有之,該方法本身並不能提供足夠的信息進行分辨。
對於以核酸雜交為原理的檢測技術,螢光檢測法的主要過程為:首先用螢光素標記擴增(也可以有其它放大技術)過的靶序列或樣品,然後與晶片上的大量探針進行雜交,將未雜交的分子洗去(如果用實時螢光檢測可省去此步 [9] )這時,用落射螢光顯微鏡或其它螢光顯微裝置對片基進行掃描,採集每點螢光強度並對其進行分析比較。前已述及,由於正常的 Watson-Crick 配對雙鏈要比具有錯配鹼基的雙鏈分子具有較高的熱力學穩定性。所以,如果探針與樣品分子在不位點配對有差異則該位點螢光強度就會有所不同,而且螢光信號的強度還與樣品中靶分子的含量呈一定的線性關係。當然,由於檢測原理及目的不同,樣品及數據的處理也自然有所不同,甚至由於每種方法的優缺點各異以至於分析結果不盡一致。
基本步驟
生物晶片是將生命科學研究中所涉及的不連續的分析過程(如樣品製備、化學反應和分析檢測),利用微電子、微機械、化學、物理技術、計算機技術在固體晶片表面構建的微流體分析單元和系統,使之連續化、集成化、微型化。
生物晶片技術主要包括四個基本要點:晶片方陣的構建、樣品的製備、生物分子反應和信號的檢測。1、晶片製備,先將玻璃片或矽片進行表面處理,然後使DNA片段或蛋白質分子按順序排列在片芯上。2、樣品製備,生物樣品往往是非常複雜的生物分子混合體,除少數特殊樣品外,一般不能直接與晶片反應。可將樣品進行生物處理,獲取其中的蛋白質或DNA、RNA,並且加以標記,以提高檢測的靈敏度。3、生物分子反應,晶片上的生物分子之間的反應是晶片檢測的關鍵一步。通過選擇合適的反應條件使生物分子間反應處於最佳狀況中,減少生物分子之間的錯配比率。4、晶片信號檢測,常用的晶片信號檢測方法是將晶片置入晶片掃瞄器中,通過掃描以獲得有關生物信息。
1、晶片製備
目前製備晶片主要以玻璃片或矽片為載體,採用原位合成和微矩陣的方法將寡核苷酸片段或cDNA作為探針按順序排列在載體上。晶片的製備除了用到微加工工藝外,還需要使用機器人技術。以便能快速、準確地將探針放置到晶片上的指定位置。
2、樣品製備
生物樣品往往是複雜的生物分子混合體,除少數特殊樣品外,一般不能直接與晶片反應,有時樣品的量很小。所以,必須將樣品進行提取、擴增,獲取其中的蛋白質或DNA、RNA,然後用螢光標記,以提高檢測的靈敏度和使用者的安全性。
3、雜交反應
雜交反應是螢光標記的樣品與晶片上的探針進行的反應產生一系列信息的過程。選擇合適的反應條件能使生物分子間反應處於最佳狀況中,減少生物分子之間的錯配率。
4、信號檢測和結果分析
雜交反應後的晶片上各個反應點的螢光位置、螢光強弱經過晶片掃瞄器和相關軟體可以分析圖像,將螢光轉換成數據,即可以獲得有關生物信息。 基因晶片技術發展的最終目標是將從樣品製備、雜交反應到信號檢測的整個分析過程集成化以獲得微型全分析系統(micro total analytical system)或稱縮微晶片實驗室(laboratory on a chip)。使用縮微晶片實驗室,就可以在一個封閉的系統內以很短的時間完成從原始樣品到獲取所需分析結果的全套操作。
實驗套用
 基因晶片
基因晶片在實際套用方面,生物晶片技術可廣泛套用於疾病診斷和治療、藥物篩選、農作物的優育優選、司法鑑定、食品衛生監督、環境檢測、國防、航天等許多領域。它將為人類認識生命的起源、遺傳、發育與進化、為人類疾病的診斷、治療和防治開闢全新的途徑,為生物大分子的全新設計和藥物開發中先導化合物的快速篩選和藥物基因組學研究提供技術支撐平台。
1、藥物篩選和新藥開發
由於所有藥物(或獸藥)都是直接或間接地通過修飾、改變人類(或相關動物)基因的表達及表達產物的功能而生效,而晶片技術具有高通量、大規模、平行性地分析基因表達或蛋白質狀況(蛋白質晶片)的能力,在藥物篩選方面具有巨大的優勢。用晶片作大規模的篩選研究可以省略大量的動物試驗甚至臨床,縮短藥物篩選所用時間,提高效率,降低風險。隨著人類基因圖譜的繪就,基因工程藥物將進入一個大發展時期,在基因工程藥物的研製和生產中,生物晶片也有著較大的市場。以基因工程胰島素為例,當我們把人的胰島素基因轉移到大腸桿菌細胞後,我們就需要用某種方法對工程菌的基因型進行分析,以便確證胰島素基因是否轉移成功。過去人們採取的方法叫做“限制性片段長度多態性”(簡稱RELP),這種方法非常地煩瑣複雜,在成本和效率方面都不如基因晶片,今後被晶片技術取代是必然的趨勢。通過使用基因晶片篩選藥物具有的巨大優勢決定它將成為本世紀藥物研究的趨勢。
2、疾病診斷
基因晶片作為一種先進的、大規模、高通量檢測技術,套用於疾病的診斷,其優點有以下幾個方面:一是高度的靈敏性和準確性;二是快速簡便;三是可同時檢測多種疾病。如套用於產前遺傳性疾病檢查,抽取少許羊水就可以檢測出胎兒是否患有遺傳性疾病,同時鑑別的疾病可以達到數十種甚至數百種,這是其他方法所無法替代的,非常有助於“優生優育”這一國策的實施。又如對病原微生物感染診斷,目前的實驗室診斷技術所需的時間比較長,檢查也不全面,醫生往往只能根據臨床經驗做出診斷,降低了診斷的準確率,如果在檢查中套用基因晶片技術,醫生在短時間內就能知道病人是哪種病原微生物感染;而且能測定病原體是否產生耐藥性、對哪種抗生素產生耐藥性、對哪種抗生素敏感等等,這樣醫生就能有的放矢地制定科學的治療方案;再如對具有高血壓、糖尿病等疾病家族史的高危人群普查、接觸毒化物質人群惡性腫瘤普查等等,如採用了基因晶片技術,立即就能得到可靠的結果,其他對心血管疾病、神經系統疾病、內分泌系統疾病、免疫性疾病、代謝性疾病等,如採用了基因晶片技術,其早期診斷率將大大提高,而誤診率會大大降低,同時有利於醫生綜合地了解各個系統的疾病狀況。
3、環境保護
在環境保護上,基因晶片也廣泛的用途,一方面可以快速檢測污染微生物或有機化合物對環境、人體、動植物的污染和危害,同時也能夠通過大規模的篩選尋找保護基因,製備防治危害的基因工程藥品、或能夠治理污染源的基因產品。
4、司法
基因晶片還可用於司法,現階段可以通過DNA指紋對比來鑑定罪犯,未來可以建立全國甚至全世界的DNA指紋庫,到那時以直接在犯罪現場對可能是疑犯留下來的頭髮、唾液、血液、精液等進行分析,並立刻與DNA罪犯指紋庫系統存儲的DNA“指紋”進行比較,以儘快、準確的破案。
5、現代農業
基因晶片技術可以用來篩選農作物的基因突變,並尋找高產量、抗病蟲、抗乾旱、抗冷凍的相關基因,也可以用於基因掃描及基因文庫作圖、商品檢驗檢疫等領域。目前該類市場尚待開發。
6、研究領域
包括基因表達檢測、尋找新基因、雜交測序、基因突變和多態性分析以及基因文庫作圖以及等方面。
(1)基因表達檢測。
人類基因組編碼大約10萬個不同的基因,僅掌握基因序列信息資料,要理解其基因功能是遠遠不夠的,因此,具有監測大量mRNA(信使RNA,可簡單理解為基因表達的中介物)的實驗工具很重要。有關對晶片技術檢測基因表達及其敏感性、特異性進行的研究實驗表明晶片技術易於監測非常大量的mRNAs並能敏感地反映基因表達中的微小變化。利用基因晶片技術人們已比較成功地對多種生物包括擬南芥、酵母及人的基因組表達情況進行了研究,並且用該技術(共157,112個探針分子)一次性檢測了酵母幾種不同株間數千個基因表達譜的差異。
(2)尋找新基因。
有關實驗表明在缺乏任何序列信息的條件下,基因晶片也可用於基因發現,如HME基因和黑色素瘤生長刺激因子就是通過基因晶片技術發現的。3、DNA測序。人類基因組計畫的實施促進了更高效率的、能夠自動化操作的測序方法的發展,晶片技術中雜交測序技術及鄰堆雜交技術即是一種新的高效快速測序方法。如使用美國Affymetrix公司1998年生產出的帶有13.5萬個基因探針的晶片就可以使人類DNA解碼速度提高了25倍。4、核酸突變的檢測及基因組多態性的分析。有關實驗結果已經表明DNA晶片技術可快速、準確地研究大量患者樣品中特定基因所有可能的雜合變異。對人類基因組單核苷酸多態性的鑑定、作圖和分型,人線粒體16.6kb基因組多態性的研究等。隨著遺傳病與癌症相關基因發現數量的增加,變異與多態性分析必將越來越重要。
基因晶片檢測原理
雜交信號的檢測是DNA晶片技術中的重要組成部分。以往的研究中已形成許多種探測分子雜交的方法,如螢光顯微鏡、隱逝波感測器、光散射表面共振、電化感測器、化學發光、螢光各向異性等等,但並非每種方法都適用於DNA晶片。由於DNA晶片本身的結構及性質,需要確定雜交信號在晶片上的位置,尤其是大規模DNA晶片由於其面積小,密度大,點樣量很少,所以雜交信號較弱,需要使用光電倍增管或冷卻的電荷偶連照相機(charged-coupled device camera,CCD)攝像機等弱光信號探測裝置。此外,大多數DNA晶片雜交信號譜型除了分布位點以外還需要確定每一點上的信號強度,以確定是完全雜交還是不完全雜交,因而探測方法的靈敏度及線性回響也是非常重要的。雜交信號探測系統主要包括雜交信號產生、信號收集及傳輸和信號處理及成像三個部分組成。
 基因晶片
基因晶片由於所使用的標記物不同,因而相應的探測方法也各具特色。大多數研究者使用螢光標記物,也有一些研究者使用生物素標記,聯合抗生物素結合物檢測DNA化學發光。通過檢測標記信號來確定DNA晶片雜交譜型。
1.螢光標記雜交信號的檢測方法
使用螢光標記物的研究者最多,因而相應的探測方法也就最多、最成熟。由於螢光顯微鏡可以選擇性地激發和探測樣品中的混合螢光標記物,並具有很好的空間解析度和熱解析度,特別是當螢光顯微鏡中使用了共焦雷射掃描時,分辨能力在實際套用中可接近由數值孔徑和光波長決定的空間解析度,而在傳統的顯微鏡是很難做到的,這便為DNA晶片進一步微型化提供了重要的檢測方法的基礎。大多數方法都是在人射照明式螢光顯微鏡(epifluoescence microscope)基礎上發展起來的,包括雷射掃描螢光顯微鏡、雷射共焦掃描顯微鏡、使用了CCD相機的改進的螢光顯微鏡以及將DNA晶片直接製作在光纖維束切面上並結合螢光顯微鏡的光纖感測器微陣列。這些方法基本上都是將待雜交對象 以螢光物質標記,如螢光素或麗絲膠(lissamine)等,雜交後經過SSC和SDS的混合溶液或SSPE等緩衝液清洗。
(1)雷射掃描螢光顯微鏡
探測裝置比較典型。方法是將雜交後的晶片經處理後固定在計算機控制的二維傳動平台上,並將一物鏡置於其上方,由氬離子雷射器產生激發光經濾波後通過物鏡聚焦到晶片表面,激發螢光標記物產生螢光,光斑半徑約為5-10μm。同時通過同一物鏡收集螢光信號經另一濾波片濾波後,由冷卻的光電倍增管探測,經模數轉換板轉換為數位訊號。通過計算機控制傳動平台X-Y方向上步進平移,DNA晶片被逐點照射,所採集螢光信號構成雜交信號譜型,送計算機分析處理,最後形成20μm象素的圖像。這種方法解析度高、圖像質量較好,適用於各種主要類型的DNA晶片及大規模DNA晶片雜交信號檢測,廣泛套用於基因表達、基因診斷等方面研究。
(2)雷射掃描共焦顯微鏡
雷射掃描共焦顯微鏡與雷射掃描螢光顯微鏡結構非常相似,但是由於採用了共焦技術因而更具優越性。這種方法可以在螢光標記分子與DNA晶片雜交的同時進行雜交信號的探測,而無須清洗掉未雜交分子,從而簡化了操作步驟大大提高了工作效率。Affymetrix公司的S.P.A.Forder等人設計的DNA晶片即利用此方法。其方法是將靶 DNA分子溶液放在樣品地中,晶片上合成寡核苷酸陣列的一面向下,與樣品池溶液直接接觸,並與DNA樣品雜交。當用激發光照射使螢光標記物產生螢光時,既有晶片上雜交的DNA樣品所發出的螢光,也有樣品地中DNA所發出的螢光,如何將兩者分離開來是一個非常重要的問題。而共焦顯微鏡具有非常好的縱向解析度,可以在接受晶片表面螢光信號的同時,避開樣品池中螢光信號的影響。一般採用氬離子雷射器(488nm)作為激發光源,經物鏡聚焦,從晶片背面入射,聚集於晶片與靶分子溶液接觸面。雜交分子所發的螢光再經同一物鏡收集,並經濾波片濾波,被冷卻的光電倍增管在光子計數的模式下接收。經模數轉換反轉換為數位訊號送微機處理,成像分析。在光電信增管前放置一共焦小孔,用於阻擋大部分激發光焦平面以外的來自樣品池的未雜交分子螢光信號,避免其對探測結果的影響。雷射器前也放置一個小孔光闌以儘量縮小聚焦點處光斑半徑,使之能夠只照射在單個探針上。通過計算機控制雷射束或樣品池的移動,便可實現對晶片的二維掃描,移動步長與晶片上寡核苷酸的間距匹配,在幾分鐘至幾十分鐘內即可獲得螢光標記雜交信號圖譜。其特點是靈敏度和解析度較高,掃描時間長,比較適合研究用。現在 Affymetrix公司已推出商業化樣機,整套系統約 12萬美元。
(3)採用了CCD相機的螢光顯微鏡
這種探測裝置與以上的掃描方法都是基於螢光顯微鏡,但是以CCD相機作為信號接收器而不是光電倍增管,因而無須掃描傳動平台。由於不是逐點激發探測,因而激發光照射光場為整個晶片區域,由CCD相機獲得整個DNA晶片的雜交譜型。這種方法一般不採用雷射器作為激發光源,由於雷射束光強的高斯分布,會使得光場光強度分布不均,而螢光信號的強度與激發光的強度密切相關,因而不利於信號採集的線性回響。為保證激發光勻場照射,有的學者使用高壓汞燈經濾波片濾波,通過傳統的光學物鏡將激發光投射到晶片上,照明面積可通過更換物鏡來調整;也有的研究者使用大功率弧形探照燈作為光源,使用光纖維束與透鏡結合傳輸激發光,並與晶片表面呈50o角入射。由於採用了CCD相機,因而大大提高了獲取螢光圖像的速度,曝光時間可縮短至零點幾秒至十幾秒。其特點是掃描時間短,靈敏度和解析度較低,比較適合臨床診斷用[14].
(4)光纖感測器
有的研究者將 DNA晶片直接做在光纖維束的切面上(遠端),光纖維束的另一端(近端)經特製的耦合裝置耦合到螢光顯微鏡中。光纖維束由7根單模光纖組成。每根光纖的直徑為200μm,兩端均經化學方法拋光清潔。化學方法合成的寡核苷酸探針共價結合於每根光纖的遠端組成寡核苷酸陣列。將光纖遠端浸入到螢光標記的靶分子溶液中與靶分子雜交,通過光纖維束傳導來自螢光顯微鏡的雷射(490urn),激發螢光標記物產生螢光,仍用光纖維束傳導螢光信號返回到螢光顯微鏡,由CCD相機接收。每根光纖單獨作用互不干擾,而溶液中的螢光信號基本不會傳播到光纖中,雜交到光纖遠端的靶分子可在90%的甲酸胺( formamide)和TE緩衝液中浸泡10秒鐘去除,進而反覆使用。這種方法快速、便捷,可實時檢測DNA微陣列雜交情況而且具有較高的靈敏度,但由於光纖維束所含光纖數目有限,因而不便於製備大規模DNA晶片,有一定的套用局限性。
2..生物素標記方法中的雜交信號探測
以生物素(biotin)標記樣品的方法由來已久,通常都要聯合使用其它大分子與抗生物素的結合物(如結合化學發光底物酶、螢光素等),再利用所結合大分子的特殊性質得到最初的雜交信號,由於所選用的與抗生物素結合的分子種類繁多,因而檢測方法也更趨多樣化。特別是如果採用尼龍膜作為固相支持物,直接以螢光標記的探針用於DNA晶片雜交將受到很大的限制,因為在尼龍膜上螢光標記信號信噪比較低。因而使用尼龍膜作為固相支持物的這些研究者大多是採用生物素標記的。
研究方向
 基因晶片
基因晶片探針的合成與固定比較複雜,特別是對於製作高密度的探針陣列。使用光導聚合技術每步產率不高( 95% ),難於保證好的聚合效果。應運而生的其它很多方法,如壓電打壓、微量噴塗等多項技術,雖然技術難度較低方法也比較靈活,但存在的問題是難以形成高密度的探針陣列,所以只能在較小規模上使用。最近我國學者已成功地將分子印章技術套用於探針的原位合成而且取得了比較滿意的結果(個人通訊)。
目標分子的標記也是一個重要的限速步驟,如何簡化或繞過這一步現在仍然是個問題。目標分子與探針的雜交會出現一些問題:首先,由於雜交位於固相表面,所以有一定程度的空間阻礙作用,有必要設法減小這種不利因素的影響。 Southern 曾通過向探針中引入間隔分子而使雜交效率提高於了 150 倍。其次,探針分子的 GC 含量、長度以及濃度等都會對雜交產生一定的影響,因此需要分別進行分析和研究。
信號的獲取與分析上,當前多數方法使用螢光法進行檢測和分析,重複性較好,但靈敏仍然不高。正在發展的方法有多種,如質譜法、化學發光法等。基因晶片上成千上萬的寡核苷酸探針由於序列本身有一定程度的重疊因而產生了大量的豐余信息。這一方面可以為樣品的檢測提供大量的驗證機會,但同時,要對如此大量的信息進行解讀,目前仍是一個艱巨的技術問題。
中國研究現狀
目前,我國尚未有較成型的基因晶片問世,但據悉已有幾家單位組織人力物力從事該技術的研製工作,並且取得了一些可喜的進展。這是一件好事,標誌著我國相關學科與技術正在走向成熟。基因晶片技術是一個巨大的產業方向,我們國家的生命科學、計算機科學乃至精密機械科學的工作者們應該也可以在該領域內占有一席之地。但是我們應該充分地認識到,這不是一件輕易的事,不能夠蜂擁而至,不能“有條件沒有條件都要上”,去從事低水平重複性的研究工作,最終造成大量人力物力的浪費。而應該是有組織、有計畫地集中具有一定研究實力的單位和個人進行攻關,這也許更適合於我國國情。