複合物學說
 酶作用機理
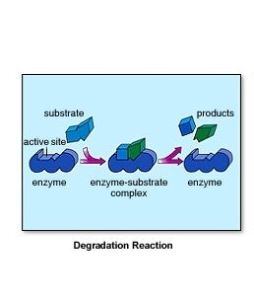
酶作用機理目前一般認為,酶催化某一反應時,首先在酶的活性中心與底物結合生成酶-底物複合物,此複合物再進行分解而釋放出酶,同時生成一種或數種產物,此過程可用下式表示:
ES的形成,改變了原來反應的途徑,可使底物的活化能大大降低,從而使反應加速。
高效率的機理
詳細機制仍不太清楚,主要有下列四種因素:
酶作用機理
1.趨近效應(approximation)和定向效應(oientation) 酶可以將它的底物結合在它的活性部位由於化學反應速度與反應物濃度成正比,若在反應系統的某一局部區域,底物濃度增高,則反應速度也隨之提高,此外,酶與底物間的靠近具有一定的取向,這樣反應物分子才被作用,大大增加了ES複合物進入活化狀態的機率。
2.張力作用(distortionorstrain)
底物的結合可誘導酶分子構象發生變化,比底物大得多的酶分子的三、四級結構的變化,也可對底物產生張力作用,使底物扭曲,促進ES進入活性狀態。
3.酸鹼催化作用(acid-basecatalysis)
酶的活性中心具有某些胺基酸殘基的R基團,這些基團往往是良好的質子供體或受體,在水溶液中這些廣義的酸性基團或廣義的鹼性基團對許多化學反應是有力的催化劑。
4.共價催化作用(covalentcatalysis)
某些酶能與底物形成極不穩定的、共價結合的ES複合物,這些複合物比無酶存在時更容易進行化學反應。
例如:無酶催化的反應 RX+H2O→ROH+Hx慢
有酶存在時 RX+E桹H→ROH+EX快
EX+H2O→E桹H+HX快?