膜平衡
正文
如果小離子和溶劑分子都能通過半透膜,在平衡時電解質在膜兩邊的濃度應相同。如果有大分子電解質存在,則它的大離子不能透過半透膜,當這一體系達到滲透平衡後,小離子在膜兩邊的濃度就不相等了,這種現象稱為膜平衡。由於這一現象是F.G.唐南發現的,又稱唐南平衡。例如,將濃度為c1的蛋白質鈉鹽(Na+R-)溶液與濃度為c2的氯化鈉(Na+Cl-)溶液用半透膜隔開(見圖)。 在起始狀態,因為蛋白質大離子R-不能擴散到膜外,而Na+與Cl-等小離子可以通過膜,為了保持膜兩邊溶液為電中性,擴散時須滿足膜內外Na+交換的數目相等和等量的Na+與Cl-同時由膜外擴散到膜內的條件。設有濃度為x 的小離子由膜外進入膜內,最後的平衡狀態如圖中 b所示。由熱力學的平衡條件可知,小離子在膜內濃度的乘積等於其膜外濃度的乘積:
在起始狀態,因為蛋白質大離子R-不能擴散到膜外,而Na+與Cl-等小離子可以通過膜,為了保持膜兩邊溶液為電中性,擴散時須滿足膜內外Na+交換的數目相等和等量的Na+與Cl-同時由膜外擴散到膜內的條件。設有濃度為x 的小離子由膜外進入膜內,最後的平衡狀態如圖中 b所示。由熱力學的平衡條件可知,小離子在膜內濃度的乘積等於其膜外濃度的乘積: 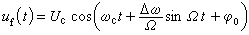
由於小分子電解質的存在對蛋白質溶液的滲透壓有很大的影響,測定滲透壓時必須消除其影響,方能得出正確的結果。膜平衡原理解決了蛋白質滲透壓測定的問題。由於膜平衡的作用,膜內蛋白質溶液對膜的滲透壓Π為:

Π=c1RT
因而蛋白質溶液的滲透壓只由其濃度決定。
