溶液中離子的擴散
正文
擴散是溶液的基本性質,是微粒(分子、原子)的熱運動而產生的物質遷移現象,主要由濃差、溫差和湍流運動引起,研究擴散可為溶液結構提供信息。液體擴散的基本公式是斐克定律:
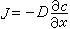
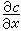 是濃度梯度。
是濃度梯度。 電解質溶液的擴散 兩組分體系中的擴散 在單組分體系中,自擴散係數用D*表示;在兩組分體系中用D奮和D奯表示。在非理想情況下,D奯為濃度的函式,如果忽略粘度η對淌度U的影響,則有:
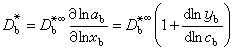
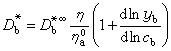
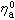 為純組分a的粘度。
為純組分a的粘度。 單電解質的擴散 在電解質溶液中,極限當量電導
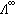 與擴散係數D+、D_之間的關係可用能斯脫-愛因斯坦公式表達:
與擴散係數D+、D_之間的關係可用能斯脫-愛因斯坦公式表達: 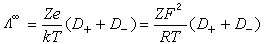
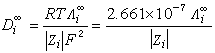
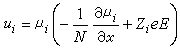
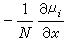 為粒子i在x方向的驅動力;μi為粒子i的化學勢;N 為阿伏加德羅數;ZieE為在電場E的存在下,帶電荷Zie的離子i遭受到的力。對於正和負離子,這個擴散速度都應該是同樣的,從式 u+=u-消除E,並套用v+Z++v-Z-=0的關係,可得:
為粒子i在x方向的驅動力;μi為粒子i的化學勢;N 為阿伏加德羅數;ZieE為在電場E的存在下,帶電荷Zie的離子i遭受到的力。對於正和負離子,這個擴散速度都應該是同樣的,從式 u+=u-消除E,並套用v+Z++v-Z-=0的關係,可得: 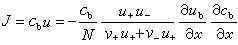
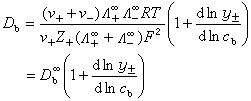
電泳效應對擴散的影響 在電導中,離子互相吸引產生兩種效應:一是鬆弛效應,即外電場的影響使對稱的離子氛轉化為非對稱的;另一種是電泳效應,即在外電場的影響下溶劑分子和離子作反向的對流。在單獨電解質的擴散里,兩種離子以相同速率向前推進,離子氛的對稱性仍能維持,因而沒有鬆弛效應,但是電泳效應仍然存在,因為離子移動時穿過溶劑,而溶劑分子的擴散方向是相反的。這個效應與電解質的濃度有關,對稱電解質從無限稀到濃度c時,可得到:
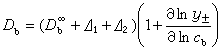
締合式電解質對擴散的影響 離子締合對擴散的影響是降低微粒的阻力。因為在液體中移動時,一個微粒的阻力總比兩個小些,結果擴散速度上升。在稀溶液中得到下式:
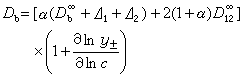
 為無限稀釋溶液中一個離子對的擴散係數,濃度為0.001~0.005摩爾/千克時D
為無限稀釋溶液中一個離子對的擴散係數,濃度為0.001~0.005摩爾/千克時D 是常數。
是常數。 互擴散對擴散的影響 在兩組分體系中,當B擴散到右邊時,為使體系平衡,必然有一些物質流到左邊,因此淨效應可被描述為與方向中的整體運動結合的 B的純擴散。在這種情況下,用單個擴散係數Dab來描述通過擴散的任一組分的濃度變化,就叫做互擴散係數。假設體積與組成無關時,Dab即為:
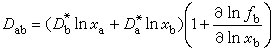
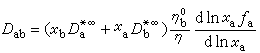
自擴散 純液體分子從一點移動到另一點的運動稱為自擴散。在溶液中實際能實現的是示蹤擴散,例如極少量的放射性 Na*離子在氯化鈉中的擴散。因為 Na*離子的濃度很小,基本無反向溶劑流動,所以電泳效應可以忽略。定量的方程為:
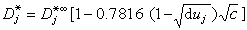
濃溶液的擴散 必須考慮溶劑的移動、溶液的粘度和離子的水化。非電解質濃溶液的擴散公式為:
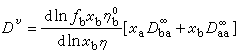
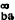 和D
和D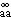 分別為b在無限稀釋下的擴散係數和純溶劑的擴散係數;Dv為兩組分體系的分體積不變時的擴散係數。
分別為b在無限稀釋下的擴散係數和純溶劑的擴散係數;Dv為兩組分體系的分體積不變時的擴散係數。 把上式用於單電解質在濃溶液中的擴散,得出高濃度下水化電解質的擴散公式:
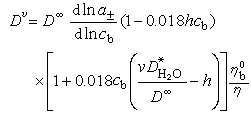
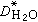 為純水的擴散係數,對1:1價態的電解質,離子個數v=2。上式能符合許多1:1價態的鹽,濃度可達1摩爾/千克,誤差約為0.5%。
為純水的擴散係數,對1:1價態的電解質,離子個數v=2。上式能符合許多1:1價態的鹽,濃度可達1摩爾/千克,誤差約為0.5%。 參考書目
黃子卿:《電解質溶液理論導論》,科學出版社,北京,1964。
