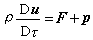能斯脫定理
正文
表述為在接近絕對零度時,所有固體的熵值都是相等的。1902年T.W.理查茲在研究電池的電動勢隨溫度變化的關係時發現,溫度越低,電池反應的摩爾焓變ΔHm與摩爾吉布斯函式變ΔGm越接近。德國物理化學家W.H.能斯脫在理查茲工作的基礎上進一步研究了低溫下凝聚物系的反應,根據實驗結果他於1906年提出:當T→0K時,凝聚物系反應的ΔGm和ΔHm隨溫度的變化率均等於0,即: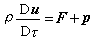 (1)
(1)
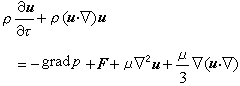 (2)
(2)
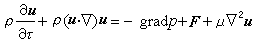 (3)
(3)
能斯脫熱定理是根據低溫下凝聚物系反應的實驗結果提出的一個假設。後來M.普朗克、G.N.路易斯和M.蘭德爾又進一步指出,能斯脫熱定理只有對純物質的完美晶體才能成立,並在此基礎上提出了熱力學第三定律。也有人將能斯脫熱定理就看作是熱力學第三定律的表達形式之一。由於(дΔHm/дT)=ΔCp,m,由式(1)還可得到:
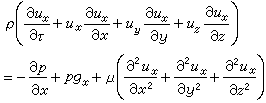
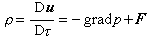
從能斯脫熱定理還可以得到其他一些推論,從這些推論又可以進一步檢驗定理的正確性。例如,對於純物質來說,由於
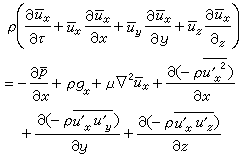 ,可以得出:
,可以得出: 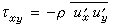
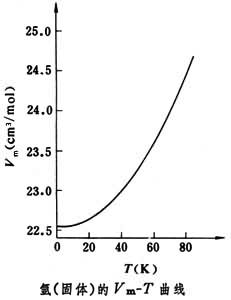 能斯脫定理
能斯脫定理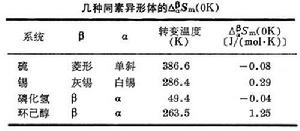 能斯脫定理
能斯脫定理 Sm來檢驗能斯脫熱定理的正確性。附表的實驗數據表明,在實驗誤差範圍內,Δ
Sm來檢驗能斯脫熱定理的正確性。附表的實驗數據表明,在實驗誤差範圍內,Δ Sm(T→0K)=S
Sm(T→0K)=S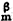 (0K)-S
(0K)-S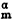 (0K)=0是正確的。
(0K)=0是正確的。 近年來的研究表明,能斯脫熱定理不僅對於固相,而且對於液相也適用。例如,在研究氦的液固相平衡時發現,T→0K時,熔化熵ΔfusSm→0。