概述
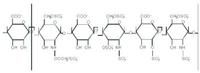 肝素
肝素肝素首先從肝臟發現而得名,天然存在於肥大細胞,現在主要從牛肺或豬小腸黏膜提取。
肝素是一種由葡萄糖胺,L-艾杜糖醛苷、N-乙醯葡萄糖胺和D-葡萄糖醛酸交替組成的黏多糖硫酸脂。
製劑分子量在1200~40000,抗血栓與抗凝血活性與分子量大小有關。
肝素具有強酸性,並高度帶負電荷
肝素是一種酸性黏多糖,主要是由肥大細胞和嗜鹼性粒細胞產生。肺·心·肝·肌肉等組織中含量豐富,生理情況下血漿中含量甚微。無論在體內還是體外,肝素的抗凝作用都很強,故臨床把它作為抗凝劑廣泛使用。
功用
1、抗凝血:
(1)增強抗凝血酶3與凝血酶的親和力,加速凝血酶的失活;
(2)抑制血小板的粘附聚集;
(3)增強蛋白c的活性,刺激血管內皮細胞釋放抗凝物質和纖溶物質。
2、抑制血小板,增加血管壁的通透性,並可調控血管新生。
3、具有調血脂的作用。
4、可作用於補體系統的多個環節,以抑制系統過度激活。與此相關,肝素還具有抗炎、抗過敏的作用。
生物學作用
可用於哺乳動物精子獲能
藥理作用
低分子量肝素的活性/抗凝血活性的比值為1.5~4.0,而普通的肝素為1,保持了肝素的抗血栓作用而降低了出血的危險。具有半衰期長,生物利用度高等優點,正廣泛套用於血栓栓塞性疾病的預防及治療,其有效性和安全性均優於普通肝素,量效關係明確,可用固定劑量無需實驗室監測調整劑量,套用方便。有實驗證明:來自水蛭素的Hiru-log多肽比肝素抗凝安全。低分子量肝素可以降低鼠移植腎臟免疫活性。方法:異體移植受體皮下注射低分子量肝素2mg/(kg·d),每周5天,持續24周。結果:低分子量肝素治療後移植腎單核吞噬細胞,T細胞的浸潤減少,主要組織相容性抗原MHC-Ⅱ的表達降低。實驗結果表明:低分子量肝素可以降低鼠移植腎臟免疫活性從而減輕移植腎臟慢性排斥反應。
臨床套用
1、肝素是需要迅速達到抗凝作用的首選藥物,可用於外科預防血栓形成以及妊娠者的抗凝治療,對於急性心肌梗死患者,可用肝素預防病人發生靜脈栓栓塞病,並可預防大塊的前壁透壁性心肌梗死病人發生動脈栓塞等。
2、肝素的另一重要臨床套用是在心臟、手術和腎臟透析時維持血液體外循環暢通。
3、用於治療各種原因引起的彌散性血管內凝血(DIC),也用於治療腎小球腎炎、腎病綜合徵、類風濕性關節炎等。
各病種治療
在臨床上肝素廣泛套用於防治血栓栓塞性疾病、瀰漫性血管內凝血的早期治療及體外抗凝。臨床套用及研究顯示:肝素除具有抗凝作用外,還具有多種生物活性和臨床用途。現簡述如下:
心絞痛
與阿司匹林合用治療不穩定型心絞痛 為觀察阿司匹林加肝素和單獨接受阿司匹林治療的不穩定型心絞痛病人發生心肌梗死(MI)和死亡的危險性 ,病人被隨機分為阿司匹林加肝素組和單獨接受阿司匹林組。研究報告了心肌梗死和死亡的發生率。不穩定型心絞痛病人接受阿司匹林加肝素治療與單獨接受阿司匹林治療相比較,隨機治療過程中MI或死亡的總的相對危險性(RR)為0.67[95%可信限(CI),0.44~1.02]。阿司匹林加肝素治療與單獨接受阿司匹林治療的病人比較,次要終點的總的RR為:反覆缺血性疼痛0.68(95%CI,0.40~1.17),隨機治療後2~12周的MI或死亡0.82(95%CI,0.56~1.20);血管再通術1.03(95%CI,0.74~1.43);重要出血1.99(95%CI,0.52~7.65)。所有試驗結果均未發現顯著的統計學異質性。結論:不穩定型心絞痛病人接受阿司匹林加肝素治療比單獨接受阿司匹林治療的MI或死亡的危險性下降33%,足夠的證據表明:大部分不穩定型心絞痛病人應同時接受阿司匹林和肝素治療。
晶體上皮細胞
抑制晶體上皮細胞的增殖或移行 後囊混濁是白內障囊外摘出術的首要併發症,肝素對晶體上皮細胞的增殖或移行有抑制作用。晶體上皮細胞的增殖、移行和纖維化在後囊混濁的發生中起重要作用。目前,後囊混濁的預防以手術中徹底清除晶體上皮細胞及皮質、植入雙凸或後凸的後房型人工晶體為主。其治療主要靠雷射後囊膜切開。研究發現,Dispase(一種中性蛋白酶)、依地酸(EDTA)、肝素及抗代謝藥5-氟尿嘧啶、柔紅黴素、秋水仙鹼、絲裂黴素等對晶體上皮細胞的移行和(或)增殖有抑制作用。多種細胞因子對晶體上皮細胞的增殖或抑制作用也引人注目。
硬腦膜竇血栓
近年來,國外在肝素和組織纖溶酶原激活物(tPA)聯用治療硬腦膜竇血栓形成中取得一定進展。組織纖溶酶原激活物(tPA)較尿激酶安全,與小分子肝素聯合套用較單用肝素藥物效果好。
潰瘍性結腸炎
對潰瘍性結腸炎(UC)發病機制中免疫異常、感染、氧自由基損傷等研究較多。此外,研究發現潰瘍性結腸炎病人血中,WF、抗心磷脂抗體、凝血酶原片段1+2、凝血酶抗凝血酶複合物、D-二聚體、組織因子途徑抑制劑、血小板球蛋白等血栓前狀態指標與健康對照者比較差異有顯著性,並有肝素成功治療難治性UC的報告 ,提示微血栓的形成可能是UC的重要發病機制之一。
急性腦梗塞
為觀察低分子肝素的治療急性腦梗塞的臨床療效和對血流動力學參數的影響,套用低分子肝素(LMWH)治療急性腦梗塞患者30例(觀察組),並以常規治療急性腦梗塞患者30例作為對照組(控制血壓、套用鈣拮抗劑、清理自由基、套用腦代謝激活劑等) 。結果:觀察組總有效率為90%,明顯高於對照組的63.3%(P<0.05)。治療前、後神經功能缺損評分比較,觀察組降低數明顯高於對照組(P<0.05)。對觀察組患者治療後全血粘度、血漿比粘度、還原比粘度、血沉以及血沉方程K值測定,均較治療前明顯降低(P<0.01)。結論:低分子肝素治療急性腦梗塞患者臨床套用安全,療效可靠,具有較強的抗凝、抗栓和降低血液粘度作用。
嚴重燒傷
嚴重燒傷並發全身多器官功能障礙,病死率較高,創面癒合後常留下瘢痕及其攣縮,並發不同程度的畸形或功能障礙。氨基葡聚糖(GAG)用於治療燒傷已有許多臨床、動物實驗研究 ,已初步揭示其抗凝、抗感染、促進血管再生等作用的機制。這些機制有利於組織修復及再上皮化。GAG有肝素、硫酸皮膚素、硫酸角蛋白、硫酸4、6軟骨素及透明質酸等,肝素含有大量硫酸基,是酸性最強的GAG,主要經腸外途徑、局部外用和吸入等方式給藥,也有製成膠丸口服,或與人工合成皮膚合用,或作為人工合成皮膚的原料。肝素治療燒傷可以緩解疼痛、抗凝、抑制炎症反應、促進血管再生,恢復局部血供,並能影響膠原的合成和降解,創面癒合後皮膚光滑,減輕瘢痕及瘢痕攣縮。肝素還能保護腸道屏障功能,減少細菌移位的發生;保護肺組織,改善肺功能;保護及改善腎功能;提高機體免疫力,預防感染。局部套用肝素是治療燒傷的一種有效手段。
其他
肝素在腫瘤套用方面:肝素的抗癌機制有增強免疫系統功能、抗增生、抑制腫瘤細胞的轉移等。肝素可與類固醇類藥物合用治療腫瘤,還可用於放療綜合徵、腫瘤併發症的治療。肝素對炎症過程的影響:肝素與肥大細胞的關係、肝素抑制白細胞粘附於血管內皮及其隨後向組織的遷移等方面表明,肝素對炎症的作用機制是有影響的。
2 低分子量肝素 低分子量肝素的活性/抗凝血活性的比值為1.5~4.0,而普通的肝素為1,保持了肝素的抗血栓作用而降低了出血的危險。具有半衰期長,生物利用度高等優點,正廣泛套用於血栓栓塞性疾病的預防及治療,其有效性和安全性均優於普通肝素,量效關係明確,可用固定劑量無需實驗室監測調整劑量,套用方便。有實驗證明:來自水蛭素的Hiru-log多肽比肝素抗凝安全。低分子量肝素可以降低鼠移植腎臟免疫活性 。方法:異體移植受體皮下注射低分子量肝素2mg/(kg·d),每周5天,持續24周。結果:低分子量肝素治療後移植腎單核吞噬細胞,T細胞的浸潤減少,主要組織相容性抗原M HC-Ⅱ的表達降低。實驗結果表明:低分子量肝素可以降低鼠移植腎臟免疫活性從而減輕移植腎臟慢性排斥反應。
用法
肝素的臨床常用方法為注射給藥,而呼吸系統疾病可採取霧化吸入達到治療目的。為評價肝素通過超聲霧化吸入治療呼吸系統疾病的療效 ,將其按一定劑量加生理鹽水20~40ml,每日1~2次超聲霧化吸入。結果:肝素總有效率94%,其超聲霧化吸入的用藥途徑,在臨床套用中證明確有療效。
不良反應
肝素的主要不良反應是易引起自發性出血,表現為各種黏膜出血、關節腔積血和傷口出血等,而肝素誘導的血小板減少症是一種藥物誘導的血小板減少症,是肝素治療中的一種嚴重併發症。藥物所致的血小板減少症主要分為兩型 :
(1)骨髓被藥物毒性作用抑制所致;
(2)藥物通過免疫機制破壞血小板所致。後者中以肝素、奎寧、奎尼丁、金鹽與磺胺類藥物發病較高。臨床症狀極不一致,血小板減少至(1.0~80)×10 9 /L,輕者無症狀,重者可因顱內出血或因肝素導致內皮細胞的免疫損害,合併危及生命的肺栓塞與動脈血栓形成致死。
診斷主要依靠:
(1)藥物治療期間血小板減少;
(2)停藥後血小板減少消除。嚴重患者血清中可檢出藥物依賴性血小板抗體,但敏感性不高而常呈假陰性。
治療的關鍵是:立即停用相關藥物,嚴重病例可使用輸注血小板、激素、丙球甚或血漿置換。
肝素不宜用於溶血尿毒綜合徵。溶血尿毒綜合徵(HUS)是小兒急性腎功能衰竭常見病因之一。兒童期典型腹瀉後HUS90%由出血性大腸桿菌O157:H7引起。目前認為 HUS發病的中心環節是內毒素啟動內皮細胞受損,繼而出現凝血系統激活,炎症介質釋放,內皮素-一氧化氮軸紊亂等多環節參與發病。全身各器官均有不同程度受累,主要是腎臟,其次是腦。治療上強調支持療法和早期透析,典型HUS的治療不提倡套用肝素、抗生素和激素。不典型HUS可適用血漿置換,有一定療效。
特效解毒劑
魚精蛋白
檢測肝素
APTT
APTT依然是作為監測UFH的選擇之一。它是非常簡單,快速和便宜的項目。然而,卻難以標準化。APTT檢測需要整個凝血瀑布中的所有蛋白都是完整的,從而可以準確測量肝素水平。有狼瘡抗凝物或抗磷脂綜合症的病人通常都有APTT升高,他們就必須使用肝素試驗來監測。除了不同凝血因子水平的因素,試劑和儀器會影響其對肝素的敏感性,導致在實驗室之間結果最終會有多達四倍的差異。國際血栓與止血協會和標準化委員會(ISTHSSC)企圖建立一個標準方法,類似PT實驗中使用的ISI一樣,給APTT試驗建立一個糾正係數。但是由於磷脂,激活劑和儀器種類的多樣化,這一工作只取得了一點進步。ISTH建議每個APTT的檢測系統都應當採用推薦的方法,通過肝素抗Xa活性來進行定標並獲得相應的APTT監測範圍。
硫酸魚精蛋白中和試驗
該試驗是基於UFH,一個高度負電荷的分子,被硫酸魚精,一個正電荷的蛋白,中和的原理。配備不同濃度的硫酸魚精蛋白加入血漿中,再加入凝血酶,測量凝固時間。將凝血酶凝固時間恢復至正常的硫酸魚精蛋白濃度就被認為是肝素的濃度,這個過程僅僅用於UFH。
抗Xa活性檢測
發色底物法檢測肝素抗Xa活性的原理都是一樣的:標本中的肝素與AT形成複合物,抑制過量添加的Xa因子。剩餘的Xa因子活性的測量,通過其與特異的底物作用,釋放出pNA來進行。這一反應與肝素濃度成反比。不同的只是反應孵育時間,稀釋用的緩衝液,底物以及是否添加外源的AT。緩衝液中的硫酸葡聚糖可以降低PF4的影響。
一步法檢測
一步法測量肝素使得檢測更加簡單,並縮短了時間。這種方法不添加外源性AT。
檢測是基於競爭抑制原理。加入Xa到血漿中與底物混合,立即同時有2個反應:底物被Xa水解和Xa被肝素-AT複合物抑制。一旦反應達到平衡,底物中釋放出的pNA與待測血漿中肝素濃度成反比。在這個檢測中,沒有添加外源性的AT,完全依賴病人血漿中的AT數量。這就代表了病人真實的肝素功能反應。病人AT水平在35%-130%之間,肝素濃度檢測不會受到影響。