警示語
1、本品的劑量限制性毒性為骨髓抑制,與以往的口服氟尿嘧啶類藥物不同,使用時應特別注意經常進行臨床檢查。
2、本品偶可引起重症肝炎等嚴重的肝損害,因此需定期檢查肝功能,以便及早發現。必須注意食欲不振、乏力等肝損害的前兆症狀,若出現黃疸(眼球黃染)應立即停藥並給予適當的處置。
3、與其他氟尿嘧啶類抗腫瘤藥,或與其他藥物聯用(如亞葉酸、替加氟、尿嘧啶聯合化療等),或與抗真菌藥氟胞嘧啶合用,可能會導致嚴重的血液功能障礙,因此不宜與上述藥物聯合用藥。
成份
本品為複方製劑,其組份為:替加氟、吉美嘧啶及奧替拉西鉀。
性狀
本品為硬膠囊劑,內容物為白色或類白色顆粒或細粉。
適應症
不能切除的局部晚期或轉移性胃癌。
規格
1、每粒含替加氟20mg、吉美嘧啶5.8mg與奧替拉西鉀19.6mg
2、每粒含替加氟25mg、吉美嘧啶7.25mg與奧替拉西鉀24.5mg
用法用量
單獨用藥:
通常,應按下表中的體表面積計算成人首次給藥劑量的基準量(1次劑量),一天2次,於早飯後和晚飯後各服1次,連服28天,之後停藥14天。此為一個周期,可以反覆進行。
體表面積 初次給藥的基準量(以替加氟計)
[1.25m[sup]2[/sup] 40mg/次
1.25[1.5m[sup]2 [/sup] 50mg/次
]1.5m[sup]2[/sup] 60mg/次
可根據患者的狀態適當增減給藥量,劑量設定為40、50、60、75mg/次。需增加劑量時,若不出現與本品有關的臨床檢查值(血液學檢查、肝腎功能檢查)異常及消化道症狀,無安全性問題,可按基準量順次增加一個劑量,但最高不得超過75mg/次;減小劑量時,按基準量順次減小一個劑量,最低給藥劑量為40mg/次。
增減劑量時可參考下表:
減量 首次劑量 增量
停藥 每次40mg 每次50mg
每次40mg→停藥 每次50mg 每次60mg
每次50mg→每次40mg→停藥 每次60mg 每次75mg
註: 以上劑量以替加氟計,增減劑量時應在每個周期按照上表順次增減。
聯合用藥:
口服替吉奧膠囊80mg/m[sup]2[/sup]/天,一天2次,於早飯後和晚飯後各服1次,連服14天,停藥7天;順鉑:75mg/m[sup]2[/sup],分三天靜脈滴注(第1、2、3天)。每3周為1個周期,應至少進行2個周期的治療。
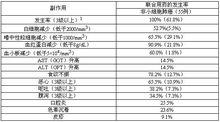
不良反應
 維康達
維康達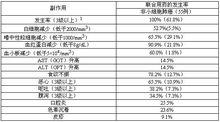 維康達
維康達國外臨床試驗結果顯示:
1、單獨給藥
在單獨給藥的臨床試驗中(曾治療過的乳腺癌、胰腺癌和膽道癌患者除外),可進行副作用評價的病例共578例,副作用發生率87.2%(504例)。曾治療過(紫杉烷類抗腫瘤藥)的乳腺癌患者(包括不能手術的乳腺癌或復發性乳腺癌(不包括前期治療的乳腺癌))、胰腺癌、膽道癌患者中的副作用發生率分別為96.4%、98.3%、94.9%,比其他腫瘤的發生率高。胰腺癌患者中,重度副作用的發生率較高,尤以食欲不振、噁心、嘔吐、腹瀉等胃腸道症狀明顯。
(1)曾治療過的乳腺癌、胰腺癌和膽道癌患者除外
(2)等級分類:按照NCI-CTC或日本癌症治療學會標準進行統計
(3)包括疲勞
2、聯合用藥
對非小細胞肺癌患者進行的Ⅱ期臨床後期聯合用藥試驗中,連續口服本品21天,第8天給予順鉑60mg/m2,可進行副作用評價的病例共55例,全部病例均發現副作用。
臨床重要副作用見下表:
註:1、等級分類:按照NCI-CTC進行統計
國內臨床試驗結果顯示:
與本品有關的不良反應發生率為83.78%,其中主要為血液系統68.47%(白細胞減少的發生率為45.05%,血小板減少的發生率為20.72%,多為I、II度下降),消化系統46.85%(噁心、嘔吐39.64%、腹瀉7.21%),其他14.41%。本品的血液系統不良反應與替加氟相當,但其消化道反應明顯好於替加氟。
本品相關不良事件的發生率為2.70%,主要表現為輕度的胃腸道出血、紅細胞降低,發生率低於替加氟(3.48%)。
禁忌
1、對本品成份有嚴重過敏史的患者。
2、嚴重的骨髓抑制患者(可能導致症狀惡化)。
3、嚴重的腎功能障礙患者。
4、嚴重的肝功能障礙患者。
5、正在使用其他氟尿嘧啶類抗腫瘤藥(包括與這些藥物的聯合化療)的患者。
6、正在使用氟胞嘧啶的患者。
注意事項
1、與用法用量有關的注意事項
(1)治療過程中,若出於治療需要而必須縮短停藥周期,則必須確認不出現與本品有關的臨床檢查值(血液學檢查、肝腎功能檢查)異常及消化道症狀,無安全性問題。停藥周期至少不得少於7天。對於不能手術或復發性乳腺癌患者縮短停藥周期的安全性尚未確立(無使用經驗)。
(2)為避免發生骨髓抑制、重症肝炎等嚴重的副作用,於各周期開始前及給藥期間每2周至少進行1次臨床檢查(血液學檢查、肝腎功能檢查等),密切觀察患者狀態。發現異常情況應採取延長停藥時間、減量、中止給藥等適當措施。特別是在第1周期及增加劑量時應經常進行臨床檢查(參照臨床試驗項)。
(3)基礎研究表明,大鼠空腹給藥時奧替拉西鉀的生物利用度變化較大,可抑制5-FU的磷酸化而使抗腫瘤作用減弱,因此本品應飯後服用。
(4)非小細胞癌患者,超出Ⅱ期臨床後期研究中的用法用量(連續21天口服本品,第8天給予順鉑60mg/m2)的有效性及安全性尚未確立。
(5)本品合併胸部和腹部放療的有效性及安全性尚未確立。
2、以下患者應慎用
(1)骨髓抑制患者。
(2)腎功能障礙患者。
(3)肝功能障礙患者。
(4)合併感染的患者。
(5)糖耐量異常的患者。
(6)間質性肺炎或既往有間質性肺炎史的患者。
(7)心臟病患者或既往有心臟病史的患者。
(8)消化道潰瘍或出血的患者。
3、重要注意事項
(1)停用本品後,至少間隔7天以上再給予其他氟尿嘧啶類抗腫瘤藥或抗真菌藥氟胞嘧啶。
(2)停用氟尿嘧啶類抗腫瘤藥或抗真菌藥氟胞嘧啶後,亦需間隔適當的時間再給予本品。
(3)曾有報導,由於骨髓抑制引起嚴重感染(敗血症),進而導致敗血症性休克或彌散性血管內凝血甚至死亡,因此須注意感染、出血傾向等症狀的出現或惡化。
(4)育齡期患者需要給藥時,應考慮對性腺的影響。
(5)曾有報導,不排除本品可導致間質性肺炎惡化甚至死亡,因此在使用本品時,須確認有無間質性肺炎,用藥過程中應密切觀察呼吸狀態,有無咳嗽、發熱等臨床症狀,並進行胸部X線檢查。注意間質性肺炎的出現和惡化。發現異常情況應停藥並採取適當措施。[特別是非小細胞肺癌患者,發生間質性肺炎等肺功能損害的可能性大於其他腫瘤患者。]
孕婦及哺乳期婦女用藥
1、孕婦及育齡期婦女禁用本品。
2、哺乳期婦女如需用藥應停止授乳。
兒童用藥
本品對出生時體重偏低的嬰兒、新生兒、嬰幼兒和兒童的安全性尚未確立。
老年用藥
一般大多數老年人生理機能低下,應觀察患者狀態,慎用本品。
藥物過量
一旦發生藥物過量,應密切監控,並進行支持、對症治療。
臨床試驗
國外臨床試驗結果
1、臨床療效(腫瘤抑制效果)
(1)單獨給藥
一日分2次口服本品(以替加氟計劑量為80-150mg/日)的臨床試驗結果顯示,有效率:胃癌為46.5%(60/129)、結直腸癌32.6%(42/129)、頭頸部癌34.1%(29/85),非小細胞肺癌(初治)18.2%(18/99)、不能手術或復發的乳腺癌21.8%(12/55)、胰腺癌32.2%(19/59)、膽道癌(未經化療的乳頭部癌、膽囊癌和肝外膽管癌)30.5%(18/59)。對非小細胞肺癌進行的II期臨床前期研究中,復治患者16例(化療9例,手術或放療7例)均無效。
(2)聯合給藥
對非小細胞肺癌(初治)患者進行的II期臨床後期研究中,連續21天口服本品,第8天給予順鉑60mg/m2,結果顯示,臨床有效率為47.3%(26/55)。
2、胃癌術後輔助化療的臨床對比試驗
以Ⅱ、Ⅲ期胃癌手術切除痊癒的患者為對象,試驗組(術後1年口服替吉奧膠囊,529例)與單純手術組(530例)比較(中位觀察期:術後3.0年)。生存期的風險比為0.675(95%可信區間:0.523-0.871,秩和檢驗p=0.0024)。試驗組死亡率比單純手術組低32%。術後3年生存率單純手術組為70.1%,試驗組為80.5%。無復發生存期的風險比為0.622(95%可信區間:0.501-0.772,秩和檢驗p[0.0001)。試驗組復發率比單純手術組低38%。3年內無復發生存率單純手術組60.1%,試驗組72.2%。
3、副作用的發生時間及恢復時間
對453例胃癌、結直腸癌、頭頸部癌、非小細胞肺癌(單獨給藥)、不能手術或復發的乳腺癌、胰腺癌和膽道癌患者進行的II期臨床後期研究中,本品給藥後重要副作用發生時間的分析結果如下:
白細胞數低於3000/mm[sup]3[/sup]、血紅蛋白低於8g/dL、血小板數低於7.5×10[sup]4[/sup]/mm[sup][/sup]3為臨床檢查異常值,從開始出現異常到降至最低值的中位時間分別為27天、25天和24天,恢復時間分別為7天、5.5天、6天。
臨床檢查項目 發生例數
(例) 降至最低值的時間
中位值(範圍) 恢復例數(例) 恢復時間
中位值(範圍)
白細胞減少 92 27(4~43)天 85 7(1~93)天
血紅蛋白減少 29 25(5~43)天 24 5.5(1~21)天
血小板減少 28 24(9~51)天 25 6(1~46)天
臨床發現與給藥有關的腹瀉、皮疹、口腔炎等副作用的病例數及發生時間(從開始給藥到首次出現症狀)及症狀消失時間的中位值分別為:
臨床症狀 發生例數
(例) 發生時間
中位值(範圍) 恢復例數
(例) 消失時間
中位值(範圍)
腹瀉 100 24.5(2~189)天 95 9(1~62)天
皮疹 67 21(2~248)天 63 14(2~254)天
口腔炎 100 28(3~262)天 94 13.5(2~99)天
4、伴發腎功能障礙時的副作用
上市後1年對胃癌的臨床使用結果表明,肌酐清除率最低的患者副作用發生率最高,程度最重。在給藥開始後減量的患者(主要是第1個周期),與按基準量開始給藥的患者相比,副作用發生率下降。
國內臨床試驗結果
1、 試驗方法
採用多中心、隨機、陽性藥平行對照試驗方法,將226名晚期胃癌患者隨機分為兩組,試驗組111例,對照組115例。
試驗組:口服替吉奧膠囊80mg/m[sup]2[/sup]/d(按體表面積給藥),分別在早餐後、晚餐後各服用1次(每日最大用量不得超過150mg),連續用藥14天,停藥休息1周為一個周期;順鉑:75mg/m[sup]2[/sup],分三天靜脈滴注(D1、2、3),三周重複。
對照組:口服替加氟800mg/m[sup]2[/sup]/d(按體表面積給藥),分3次服用,連續用藥14天,停藥休息1周為一個周期。順鉑:75mg/m[sup]2[/sup],分三天靜脈滴注(D1、2、3),三周重複。
每組患者至少進行2個周期的治療方可進行療效評價。如CR、PR或SD可繼續治療至病情進展,PD改用其他化療方案或放療等。CR、PR必須在四周后確認。
2、觀察指標
(1)有效性指標
主要療效指標:有效率、好轉率、受益率、生存期。
次要療效指標:KPS評分、體重。
(2)安全性指標:實驗室檢查、生命體徵、不良事件。
3、試驗結果
試驗組的有效率(27.93%)顯著高於對照組(7.83%)。其中,初治患者試驗組的有效率(30.77%)顯著高於對照組(10.91%);復治患者試驗組的有效率(25.42%)顯著高於對照組(5.00%)。
試驗組的好轉率(48.65%)顯著高於對照組(23.48%)。其中,初治患者試驗組的好轉率(50.00%)顯著高於對照組(23.64%);復治患者試驗組的好轉率(47.46%)顯著高於對照組(23.33%)。
試驗組的受益率(81.98%)顯著高於對照組(66.96%)。其中,初治患者試驗組和對照組的受益率分別為84.62%和65.45%;復治患者試驗組和對照組的受益率分別為79.66%和68.33%。
試驗組的中位生存期為10.51個月,對照組為8.11個月。
治療第2周期末與基線相比,試驗組KPS評分平均增加7.79,而對照組平均降低5.70,兩組的變化值差異有統計學意義。對於初治患者,試驗組平均增加8.09,而對照組平均降低4.04,兩組的變化值差異有統計學意義。對於復治患者,試驗組平均增加7.55,而對照組平均降低7.17,兩組的變化值差異有統計學意義。無論是初治、復治還是所有患者,試驗組KPS的變化情況均顯著好於對照組。
治療第2周期末與基線相比,試驗組與對照組體重的變化值均無統計學意義,兩組的變化值差異亦無統計學意義。無論是初治、復治還是所有患者,兩組治療前後體重的變化情況均無顯著差異。
藥理毒理
藥理作用:
1、抗腫瘤作用
本品對吉田氏肉瘤、AH-130腹水型肝癌、佐藤氏肺癌(大鼠)、S-180肉瘤、Lewis肺癌、Colon 26(小鼠)等各種皮下移植腫瘤,以及人胃癌、大腸癌、乳腺癌、肺癌、胰腺癌、腎臟癌皮下移植腫瘤(裸鼠)具有抑制腫瘤增殖的作用。
此外,本品對Lewis肺癌肺轉移模型及L5178Y肝轉移模型(小鼠)具有延長存活期的作用,對人胃癌、大腸癌細胞移植模型(裸鼠)具有抑制腫瘤增殖的作用。
2、作用機制
本品是由替加氟、吉美嘧啶、奧替拉西鉀組成的複方製劑,口服給藥後替加氟在體內緩慢轉變為5-FU而發揮抗腫瘤作用。
吉美嘧啶主要在肝臟分布,對5-FU分解代謝酶DPD具有選擇性拮抗作用,從而使由替加氟轉變成5-FU的濃度增加,繼而使腫瘤內5-FU的磷酸化代謝產物5-FUMP以高濃度持續存在,增強了抗腫瘤作用。
奧替拉西鉀口服給藥後主要對消化道內分布的乳清酸磷酸核糖基轉移酶有選擇性拮抗作用,從而選擇性地抑制5-FU轉變為5-FUMP。上述作用的結果使本品口服後抗腫瘤作用增強,但消化道毒性降低。
毒理研究:
急性毒性試驗結果顯示:小鼠的LD50為441-551mg/kg,Beagle犬的LD50為53mg/kg。
長期毒性試驗結果顯示:本品對SD大鼠、Beagle犬連續口服給藥13-52周,主要毒性作用靶器官是骨髓造血幹細胞。
藥代動力學
1、藥代動力學
(1)血藥濃度
12名癌症患者於餐後單次口服本品,劑量為32-40mg/m2,根據血藥濃度計算的藥代動力學參數見下表:
表1藥代動力學參數(n=12,mean±S.D.)
Cmax (ng/ml) Tmax (hr) AUC(0-48h) (ng · hr/ml) T1/2 (hr)
替加氟 1971.0±269.0 2.4±1.2 28216.9±7771.4 13.1±3.1
5-FU 128.5±41.5 3.5±1.7 723.9±272.7 1.9±0.4
吉美嘧啶 284.6±116.6 2.1±1.2 1372.2±573.7 3.0±0.5
奧替拉西鉀 78.0±58.2 2.3±1.1 365.7±248.6 3.0±1.4
氰尿酸 117.9±184.4 3.4±1.0 892.0±1711.7 3.8±1.6
給藥後72小時內尿中各成份的累積排泄率分別為:吉美嘧啶52.8%、替加氟7.8%、奧替拉西鉀2.2%、代謝物氰尿酸11.4%、5-FU 7.4%。
口服本品25-200mg/人後,替加氟、吉美嘧啶、奧替拉西鉀和5-FU的AUC值和Cmax呈劑量依賴性上升。一日2次,連續28天口服本品32~40mg/m[sup]2[/sup],分別於第1、7、14、28天測定血藥濃度,結果顯示血藥濃度迅速達穩態。此外,連續給藥後內源性尿嘧啶迅速減少,表明吉美嘧啶對DPD的可逆性抑制作用增強。
(2)大鼠連續7天單用本品或與其他氟嘧啶類藥物合用,與末次給藥後2小時測定血漿中5-FU的血藥濃度。結果顯示,與5-FU、替加氟、替加氟-尿嘧啶、卡莫氟、去氧氟尿苷、氟胞嘧啶合用後5-FU的濃度分別為單用本品組的4.1倍、8.1倍、2.8倍、5.7倍、6.9倍、2.3倍,從而有可能使合用組的副作用增加。
(3)腎功能正常和腎功能輕度損傷患者的AUC值如下表:
表2 腎功能不同的患者口服本品後各組份的AUC值(mean±S.D.)
Ccr估計值 AUC(0-8hr)
]80mL/min
(n=17) 50~80 mL/min
(n=11)
替加氟 10060±1842 11320±2717
5-FU 541.2±174.8 812.4±244.9
吉美嘧啶 977.8±327.9 1278.0±306.6
奧替拉西鉀 155.7±97.5 458.2±239.7
註:Cockcroft-Gault公式:
肌酐清除率=(140-年齡)´體重(kg)/(72´血清肌酐值(mg/dL))
(對於女性應將上述數值´0.85)
2、蛋白結合
體外試驗顯示,處方中各成份及5-FU的人血清蛋白結合率分別為:替加氟49-50%、吉美嘧啶32-33%、奧替拉西鉀7-10%、5-FU 17-20%。
3、代謝酶
體外試驗顯示,參與由替加氟轉變為5-FU的酶主要是人肝微粒體細胞色素P450 中的CYP2A6。
貯藏
室溫、密閉保存。
包裝
鋁塑包裝。20mg規格(以替加氟計):14粒/盒,28粒/盒,42粒/盒
25mg規格(以替加氟計):12粒/盒,24粒/盒,36粒/盒
有效期
24個月
生產企業
山東新時代藥業有限公司
核准日期
2008年12月19日
修訂日期
2010年01月12日 2010年02月01日