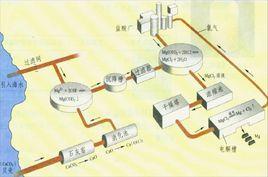
可行分析
海水鹽分中鎂的占有量僅次於氯和鈉,位居第三。鎂具有重量輕、強度高等特點。鎂合金可用來製造飛機、艦艇;鎂鋰合金的重量最輕,又最耐熱,因而在軍事工業和民用企業上具有極其重要的意義。同時它被廣泛套用於火箭、飛彈、飛機製造業,以及汽車、精密機器等各個領域。各國鋼鐵工業的迅速發展,不僅對鎂砂(氧化鎂)的數量要求日益增多,而且也對煉鋼所需的優質鎂砂要求其雜質含量在2%~4%以下。這個要求用陸上天然菱鎂礦燒結後制的鎂砂是無法達到的。而且海水提取,早在20世紀60年代其純度就已達到96%~98%,目前純度又升至99.7%。如此超高純度的鎂砂,無疑最能滿足冶金工業的特殊需要。
目前,從滷水中提取的產品主要是氯化鎂、硫酸鎂、氧化鎂和氫氧化鎂等。
提取方法
海水中提取鎂
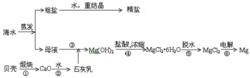
石灰乳 鹽酸
↓ ↓
海水→沉澱池→氫氧化鎂→六水合氯化鎂(MgCl2·6H2O)無水MgCl2Mg
 海水提鎂流程圖
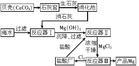
海水提鎂流程圖從海水中提鎂,可按如下步驟進行:(1)將貝殼煅燒後製成石灰乳 CaCO3=高溫=CaO+CO2↑ CaO+H2O==Ca(OH)2
(2)在引入的海水中加入石灰乳、沉降、過濾、洗滌得到Mg(OH)2MgCl2+ Ca(OH)2==Mg(OH)2↓+ CaCl2
(3)將沉澱物與鹽酸反應、反應後的溶液結晶、過濾、乾燥得MgCl2·6H2O產物(4)將MgCl2·6H2O產物 在一定的條件下加熱失去結晶水 Mg(OH)2 + 2HCl==MgCl2 + 2H2O
(5)熔融MgCl2進行電解的鎂和氯氣MgCl2(熔融)=通電=Mg+Cl2↑
氧化還原法
 海水提鎂
海水提鎂要使+2價的鎂離子得到電子而還原成單質鎂,是比較困難的。如果用類似煉鐵的方法冶煉鎂,需要很高的溫度。例如在2000℃下用焦炭還原氧化鎂,才能製得單質鎂。這樣得到的鎂常含有較多的雜質。
MgO+C----Mg+CO↑
電解法
因此,工業上常用電解法使鎂離子在陰極得到電子,還原成單質鎂。用電解的方法冶煉鎂,先要獲得含有鎂離子的熔融液。在鎂的化合物中,典型的離子化合物有氧化鎂和氯化鎂。氧化鎂的熔點太高(2800℃),而氯化鎂的熔點要低得多(714℃)。所以人們選擇氯化鎂作為電解製取鎂的原料。
用鹽酸溶解氫氧化鎂(或氧化鎂),再使溶液濃縮,就得到氯化鎂。
Mg(OH)2+2HCl=MgCl2+2H2O
在熔融的氯化鎂中有能自由移動的鎂離子。通入直流電後,氯離子向陽極移動,在陽極上失去電子,氧化成氯原子,兩個氯原子結合成1個氯分子;鎂離子向陰極移動,在陰極上得到電子,還原成單質鎂。兩個電極上發生的反應是
陽極:2Cl-―2e=Cl2↑
陰極:Mg2﹢+2e=Mg
總的電解反應方程式可以表示如下:
MgCl2(熔融)---通電---Mg+Cl2↑
為了防止生成的鎂在高溫下被空氣中的氧氣氧化,電解時需要在特殊的真空環境下進行。