概述
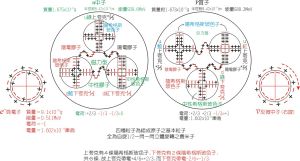 原子(電子 質子和中子)-內部結構模型圖
原子(電子 質子和中子)-內部結構模型圖 原子的化學性質與分子的相似,大致為:
一 質量、體積小;
二 總在不斷運動;
三 原子間是有間隔的。
性質 原子的質量主要集中在原子核上。(電子質量太小可以忽略不計)
原子是由原子核和電子組成的。原子核中含有質子,但不一定含有中子(如:氫原子)
質子數 決定原子種類(由此,排出元素周期表)
原子核的質量 決定原子的質量。
原子的化學性質 決定於原子最外層電子數。
質量
質量數(mass number)由於質子與中子的質量相近且遠大於電子,所以用原子的質子和中子數量的總和定義原子質量,稱為質量數。
相對原子質量
原子的靜止質量通常用統一原子質量單位(u)來表示,也被稱作 道爾頓(Da)。這個單位被定義為電中性的碳12質量的十二分之一,約為1.66×10-27kg。氫最輕的一個同位素氕是最輕的原子,重量約為1.007825u。一個原子的質量約是質量數與原子質量單位的乘積。最重的穩定原子是鉛-208,質量為207.9766521u。
摩爾(mol)
就算是最重的原子,化學家也很難直接對其進行操作,所以它們通常使用另外一個單位摩爾。摩爾的定義是對於任意一種元素,一摩爾總是含有同樣數量的原子,約為6.022×10^ 23個。因此,如果一個元素的原子質量為1u,一摩爾該原子的質量就為0.001kg,也就是1克。例如,碳-12的原子質量是12u,一摩爾碳的質量則是0.012kg。
原子半徑
原子沒有一個精確定義的最外層,通常所說的原子半徑是根據相鄰原子的平均核間距測定的。共價半徑
我們測得 氯氣分子中兩個Cl原子的核間距為1.988Α,就把此核間距的一半,即0.994Α定為氯原子的半徑,此半徑稱為共價半徑。共價半徑為該元素單質 鍵長的一半
金屬半徑
另外,我們也可以測得金屬單質比如銅中相鄰兩個銅原子的核間距,其值的一半稱為金屬半徑。
范德華半徑
指在分子晶體中,分子間以范德華力結合,如稀有氣體相鄰兩原子核間距的一半.
部分元素的原子半徑表
下表為一些元素的原子半徑( pm),數據取自《無機化學-第四版》(2000年)和 j.chem.phys(1967)。
| 元素 | 氫 | 氦 | 鋰 | 鈹 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 |
| 半徑 | 37 | 122 | 152 | 111 | 88 | 77 | 70 | 66 | 64 | 160 |
| 元素 | 鈉 | 鎂 | 鋁 | 矽 | 磷 | 硫 | 氯 | 氬 | 鉀 | 鈣 |
| 半徑 | 186 | 160 | 143 | 117 | 110 | 104 | 99 | 191 | 227 | 197 |
| 元素 | 鈧 | 鈦 | 釩 | 鉻 | 錳 | 鐵 | 鈷 | 鎳 | 銅 | 鋅 |
| 半徑 | 161 | 145 | 132 | 125 | 124 | 124 | 125 | 125 | 128 | 133 |
| 元素 | 鎵 | 鍺 | 砷 | 硒 | 溴 | 氪 | 銣 | 鍶 | 釔 | 鋯 |
| 半徑 | 122 | 122 | 121 | 117 | 114 | 198 | 248 | 215 | 181 | 160 |
| 元素 | 鈮 | 鉬 | 鎝 | 釕 | 銠 | 鈀 | 銀 | 鎘 | 銦 | 錫 |
| 半徑 | 143 | 136 | 136 | 133 | 135 | 138 | 144 | 149 | 163 | 141 |
| 元素 | 銻 | 碲 | 碘 | 氙 | 銫 | 鋇 | ||||
| 半徑 | 141 | 137 | 133 | 217 | 265 | 217 |
註:許多元素的半徑值在不同書籍中差異較大,其原因有
①原子半徑的單位有(pm)和埃(Α)兩種,Α=100pm
②原子半徑的測定方法不同
③原子半徑的種類不同
原子半徑的周期規律
在元素周期表中,原子的半徑變化的大體趨勢是自上而下增加,而從左至右減少。因此,最小的原子是氫,半徑為0.28Α;最大的原子是銫,半徑為2.655Α。因為這樣的尺寸遠遠小於可見光的波長(約400~700nm),所以不能夠通過光學顯微鏡來觀測它們。然而,使用掃描隧道顯微鏡,我們能夠觀察到單個原子。
磁性
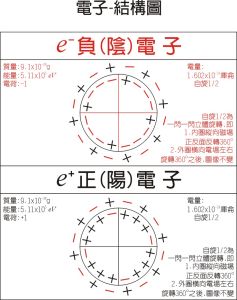 電子-模型圖
電子-模型圖 分子軌道理論可以很好地解釋分子的磁性問題,例如氧氣的順磁性。
逆磁性
一些物質的原子中電子磁矩互相抵消,合磁矩為零。當受到外加磁場作用時,電子軌道運動會發生變化,而且在與外加磁場的相反方向產生很小的合磁矩。常見的逆磁性金屬有Bi、Cu、Ag、Au。
順磁性
順磁性物質的主要特點是原子或分子中含有沒有完全抵消的電子磁矩,因而具有原子或分子磁矩。但是原子磁矩之間並無強的相互作用(一般為 交換作用),因此原子磁矩在熱騷動的影響下處於無規(混亂)排列狀態,原子磁矩互相抵消而無合磁矩。但是當受到外加磁場作用時,這些原來在熱騷動下混亂排列的原子磁矩便同時受到磁場作用使其趨向磁場排列和熱騷動作用使其趨向混亂排列,因此總的效果是在外加磁場方向有一定的磁矩分量。這樣便使磁化率(磁化強度與磁場強度之比)成為正值,但數值也是很小,一般順磁物質的磁化率約為十萬分之一(10-5),並且隨溫度的降低而增大。
常見的順磁性物質有:氧氣、一氧化氮、鉑。
核性質
放射性某些物質的原子核能發生 衰變,放出我們肉眼看不見也感覺不到的射線,只能用專門的儀器才能探測到的 射線。物質的這種性質叫放射性。
衰變
不穩定(即具有放射性)的原子核在放射出 粒子及能量後可變得較為穩定,這個過程稱為衰變(Radioactive decay)。這些粒子或 能量(後者以電磁波方式射出) 統稱輻射(radiation)。由不穩定原子核發射出來的輻射可以是α粒子、β粒子、γ射線或中子。
放射性核素在衰變過程中,該核素的原子核數目會逐漸減少。衰變至只剩下原來質量一半所需的時間稱為該核素的 半衰期(half-life)。每种放射性核素都有其特定的半衰期,由幾 微秒到幾百萬年不等。
原子核由於放出某種粒子而變為新核的現象.原子核是一個量子體系,核衰變是原子核自發產生的變化,它是一個量子 躍遷過程,它服從量子 統計規律.對任何一個放射性核素,它發生衰變的精確時刻是不能預知的,但作為一個整體,衰變的規律十分明確.若在dt時間間隔內發生核衰變的數目為dN,它必定正比於當時存在的原子核數目N,顯然也正比於時間間隔dt
衰變有3種: α衰變 、 β衰變 和γ衰變。
核裂變(unclear fission)
核裂變指是一個原子核分裂成幾個原子核的變化,核裂變通常由中子轟擊質量數較大的原子核引起,原子核裂變後會形成兩個質量相當的部分,並放出能量,有時會導致 鏈式反應的發生。
核聚變( nuclear fusion)
當多個粒子聚集形成更重的原子核時,就會發生核聚變,例如兩個核之間的高能碰撞。常見的核聚變發生於氘與氚之間。
在太陽的核心,質子需要3-10KeV的能量才能夠克服它們之間的相互排斥,也就是庫倫障壁,進而融合起來形成一個新的核。
光譜
參見“ 原子軌道”在穩定狀態下,原子中的電子位於離核最近的軌道上,這時的原子就被稱為基態原子;電子吸收能量後躍遷到更高的軌道上,這時原子就處於激發態。由於原子的軌道是量子化的,因此原子的能量發生變化時,會吸收(放出)特定的能量,產生不同的光譜圖像, 古斯塔夫·羅伯特·基爾霍夫( Gustav Robert Kirchhoff)和 羅伯特·威廉·本生( Robert Wilhelm Bunson)最早套用這一性質對不同元素的原子進行鑑定。
焰色反應(flame test)
當原子的光譜落在可見光區時,肉眼就可以看見不同的顏色,這是有些元素的原子在灼燒時引起火焰顏色變化的原因,這種變化被稱為焰色反應,可以粗略地檢測某些元素原子的存在。
下表給出部分金屬(或金屬離子)焰色反應產生的顏色
| 類別 | 鋰離子 | 鈉離子 | 鉀離子 | 銣離子 | 鈣離子 | 鍶離子 | 鋇離子 | 銅離子 |
| 顏色 | 紫紅 | 黃 | 淡紫 | 紫 | 磚紅 | 洋紅 | 黃綠 | 綠 |
價電子
價電子是原子參與化學反應的電子數,價電子數與原子的化學性質密切相關,對於主族元素來說,價電子數等於其最外層電子數;對於副族元素,價電子數包括最外層電子數和次外層的d(有時還包括f)軌道的電子數,元素周期表中通常會用電子排布式標示一個特定元素的價電子。根據價電子的不同,元素周期表可以分為s區、p區、d區、ds區、f區。化合價
