研究背景
 1967年瘧疾防治領導小組組成
1967年瘧疾防治領導小組組成 瘧疾是危害嚴重的世界性流行病,全球百餘國家每年約有三億多人感染瘧疾。1964年,越南戰爭爆發,當時北越軍隊常出沒于山間叢林地區,而這一地區惡性瘧疾流行猖獗,且對奎寧及奎諾酮類抗瘧藥物如氯喹(chloroquine)等普遍具有耐藥性,平民與軍隊的患病人數猛增,越南政府向外界請求支援。中國政府於1967年5月23日在北京成立5·23抗瘧計畫辦公室,統一領導《5·23 抗瘧計畫》的實施,其全稱為中國瘧疾研究協作項,代號為"523"。領導小組由國家科委(正組長)、總後勤部(副組長)、國防科委、衛生部、化工部、中國科學院各派一名代表組成,直接歸國家科委領導。辦事機構以中國人民解放軍後字236部隊為主(推測為軍事醫學科學院代號),辦公室設在後字236部隊。不過,由於進展和當時的政治環境,"523"領導小組曾多次發生變動,如1971年5月22日廣州召開的全國瘧疾防治研究工作座談會上,領導小組改為由衛生部(正組長)、總後衛生部(副組長)、化工部和中國科學院組成。後來,一位研究人員曾調侃,正是由於這一項目,“使得在當時到處停工的醫藥研究單位留下了一支隊伍” 。
 1967年“523”計畫研究專題
1967年“523”計畫研究專題 1969年,在軍事醫學科學院駐衛生部中醫研究院軍代表的建議下,全國“523辦公室”邀請北京中藥所加入“523任務”的“中醫中藥專業組”。北京中藥所指定化學研究室的屠呦呦擔任組長。當時的基本思路是採取民間驗方,然後利用現代的有機溶劑分離藥用部位並進行相應的藥理篩選和臨床驗證,研究人員整理了多達808種可能的中藥。據稱她們開始並未考慮使用青蒿,因為它的抑制率極不穩定,在12~80%,直至看到東晉葛洪《肘後備急方》中將青蒿“絞汁”用藥,從而得到啟發,以現代科學組織篩選,改用乙醚提取。1971年10月,青蒿的動物效價由30%~40%提高到95%。1971年12月下旬,用乙醚提取物與中性部分分別對感染伯氏瘧原蟲( Plasmodium berghei)小鼠以及感染猴瘧原蟲( Plasmodium cyomolgi)猴的瘧原蟲血症(parasitemia)顯示 100%的療效 。
1972年初抗瘧有效單體從植物青蒿中分離得到,當時的代號為“結晶Ⅱ”,後改名為“青蒿Ⅱ”,最後定名為青蒿素。1972年3月8日,《用毛澤東思想指導發掘抗瘧中草藥工作》的報告在"523"計畫內部會議上發布。效果雖好,但在批量生產時相關藥廠不願意承擔提取藥品任務,使得項目組只好把實驗室當成了生產車間,而由於乙醚易燃,結果在屠呦呦作報告的當日,由於操作人員不慎而引發大火,這一事故差點使得計畫夭折 。
 海南昌江青蒿乙醚中性部分臨床療效情況
海南昌江青蒿乙醚中性部分臨床療效情況 由於計畫時間進度緊張,為了儘早套用於臨床,1972年5月計畫部分相關研究人員(包括屠呦呦)用自身進行人體試驗並獲得通過,8月在海南部分地區進行臨床試驗,在選試的 21 例瘧疾患者中, 感染惡性瘧或間日瘧(subtertian or tertian malaria)者各占半數。經治療後, 患者的發熱症狀可迅速消失, 血中瘧原蟲的數目銳減,而接受氯喹的對照組患者則無效(個別數據存在爭議,也有個別參與人員回憶年份為1973年) 。
1975年,由北京中藥所和上海有機所藉助國內僅有的幾台大型儀器確定了青蒿素的分子式,年底通過單晶X射線衍射分析確定其分子結構,1978年由反常散射的X射線衍射分析確定了青蒿素的絕對構型。
1977和1979年,青蒿素的研究成果在中國《科學通報》與《化學學報》上發表,同年青蒿素的分子式被美國《化學文摘》收錄 。
1979年9月,依國家醫藥管理總局建議,"523"計畫列入各級民用醫藥科研計畫之中,不再另列醫藥軍工科研項目。1981年3月3日到3月6日,"523"計畫舉行最後一次小組會議;5月該會議紀要下發,"523"計畫結束 。
1981年10月,世界衛生組織主辦的第四屆瘧疾化療研討會在北京召開上,屠呦呦就《青蒿素的化學研究》一題作首位發言,引起與會代表極大的興趣,並認為“這一新的發現更重要的意義是在於將為進一步設計合成新藥指出方向”。在這次報告中,屠呦呦提出應研發複方青蒿素以防止和延緩抗藥性出現的構想,但並未受到國際同行的重視,中國開始自行研發複方藥物,開發出複方蒿甲醚等系列複方藥。2005年,醫學刊物《柳葉刀》發表文章,指出研究發現使用單方青蒿素的地區瘧原蟲對青蒿素敏感度下降,這意味著瘧原蟲有開始出現抗藥性的可能,世衛組織開始全面禁止使用單方青蒿素,改用青蒿素的聯合療法(artemisinin combination therapy,ACT),並推薦多種聯合治療, 即每種方案包括青蒿素類化合物, 配以另1 種化學藥物。這說明當年中國科學家的預見是對的 。
1986年,青蒿素和雙氫青蒿素獲一類新藥證書,1992年獲得“全國十大科技成就獎”,1997年獲得“新中國十大衛生成就”之一稱號 。
2011年9月,屠呦呦因青蒿素和雙氫青蒿素的貢獻,獲得被譽為諾貝爾獎風向標的拉斯克獎 。
2015年10月,屠呦呦因創製新型抗瘧藥—青蒿素和雙氫青蒿素的貢獻,“ or her discoveries concerning a novel therapy against Malaria”,與另外兩位科學家獲2015年度諾貝爾生理學或醫學獎 。
2016年,科學雜誌《eLife》刊登,德國馬克斯普朗克分子植物生理學研究所專家發明了利用COSTREL方法從菸草中大量提取青蒿素的方法 。
理化性質
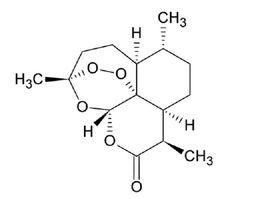
青蒿素是一種無色針狀晶體,化學名稱為(3R,5aS,6R,8aS,9R,12S,12aR)-八氫-3,6,9-三甲基-3,12-橋氧-12H-吡喃〔4,3-j〕-1,2-苯並二塞平-10(3H)-酮。分子式為CHO,屬倍半萜內酯,具有過氧鍵和6-內酯環,有一個包括過氧化物在內的1,2,4-三噁結構單元,這在自然界中十分罕見,分子中包括有7個手性中心,它的生源關係屬於amorphane類型,其特徵是A,B環順聯,異丙基與橋頭氫呈反式關係。
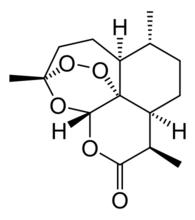 青蒿素的化學結構
青蒿素的化學結構 製備熔點為156-157℃, [a]=+66.3°(C=1.64氯仿)。 本品在丙酮、乙酸乙酯、三氯甲烷中易溶,在甲醇、乙醇、稀乙醇、乙醚及石油醚中溶解,在水中幾乎不溶;在冰醋酸中易溶 。因其具有特殊的過氧基團,它對熱不穩定,易受濕、熱和還原性物質的影響而分解 。
製備方法
化學合成
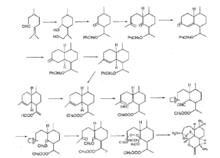 青蒿素化學合成途徑
青蒿素化學合成途徑 通過化學途徑合成青蒿素的難度極大。1986年,中國科學院上海有機所以R(+)一香草醛為原料合成了青蒿素,國外也有類似工作,反應以(-)- 2-異薄勒醇為原料,通過光氧化反應引進過氧基,保留原料中的六元環,環上三條側鏈烷基化,形成中間體,最後環合成含過氧橋的倍半萜內酯。但這些合成過程均過於複雜,尚未顯示出商業的可行性 。
生物合成
萜類化合物的生物合成途徑非常複雜,對於青蒿素這一類低含量的複雜分子的生物合成研究更是如此。用以下三種途徑可生物合成青蒿素:通過添加生物合成的前體來增加青蒿素的含量;通過對控制青蒿素合成的關鍵酶進行調控,或者對關鍵酶控制的基因進行激活來大幅度增加青蒿素的含量;利用基因工程手段來改變關鍵基因以增強它們所控制酶的效率 。
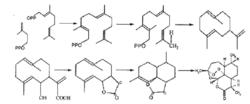 青蒿素生物合成途徑
青蒿素生物合成途徑 對於倍半萜內酯的合成,其限速步驟一是環化和摺疊成倍半萜母核的過程,另一個限速步驟為形成含過氧橋的倍半萜內酯過程。研究人員通過放射性元素示蹤法對青蒿素的生物合成途徑進行了研究,認為青蒿素的生物合成可以從法尼基焦磷酸出發,經耗牛兒間架(germacrane)、雙氫木香交酯(dihydrocostunodile)、杜松烯內酯(cardinanolide)和青薔素B(arteannuin B),最終合成青蒿素 。
當然除青蒿外,其他植物並非不可行。2011 年研究人員就使用甲羥戊酸,從菸草中合成出了青蒿素 。
提取純化
商用的青蒿素主要來自於植物提取物,理論上植物中青蒿素含量達以上的青篙才有提取青蒿素的價值。而天然植物中青蒿素的含量受地理環境、採集時間、採集部位、氣溫和施肥等因素的影響。中國北方產的黃花蒿中青蒿素含量極低。20世紀60-70年代就有單位進行過中藥青蒿的分離研究,但未有所獲,後來推測可能和產地分布有關。即使在能夠提取青蒿素的地區,不同產地青蒿素的含量差異也很顯著,最高可達乾重的1~2%。有人認為青篙的採集期在生長盛期至花蕾期之前較好,一天中採集時間以晴天中午12~16時為宜。而在青篙植物的上部和枝條上部的葉片中,青篙素含量最高,嫩葉比老葉的含量高。不同乾燥方法也有一定的影響,自然曬乾的效果比陰乾的樣品含量高。
從青蒿中提取青蒿素的方法是以萃取原理為基礎,主要有乙醚浸提法和溶劑汽油浸提法。揮髮油主要採用水蒸汽蒸餾提取,減壓蒸餾分離,其工藝為:投料---加水---蒸餾---冷卻---油水分離---精油;非揮發性成分主要採用有機溶劑提取,柱層析及重結晶分離,基本工藝為:乾燥---破碎---浸泡、萃取(反覆進行)---濃縮提取液---粗品---精製 。
相對具體方法比如,丙酮一矽膠柱層析法,將植物青篙的葉子和花蕾用丙酮浸泡二次,每次一小時,合併濾出液,常壓回收丙酮至小體積,然後加入乙醇於小體積的丙酮提取液中進行脫蠟,在50℃以下攪拌混勻,使其基本溶解後,在10℃以下放置12小時,用紗布過濾。所得乙醇濾液進行層析分離,可得青蒿素。或用低沸汽油-超短粗型球狀擴孔矽膠過濾層吸法,採用低沸點汽油為溶劑,反覆熱回流浸提青蒿乾碎葉,熱回流時間至少10小時,反覆至少4次,將提取液通過裝有球形擴孔矽膠的超短粗柱,進行選擇性過濾。採用異丙醇或醋酸乙酷同低沸點汽油的混合液為洗脫液通過柱體進行洗脫,然後濃縮流出液,即得青蒿素粗品 。
也可採取超臨界法提取,比如在提取壓力8~32MPa,提取溫度30~70℃,解析壓力4~8MPa,解析溫度30~70℃下通過循環分離青蒿素,提取時間0.5~5小時,提取率可達92% 。
青蒿素的提取方法雖多,但弊端同樣不少。汽油法簡練,工藝流程短,操作方便,但此法大量消耗汽油,安全性存在問題,且由於沸點高,母液處理困難,需減壓回收,回收率低。乙醇法溶劑回收溫度較難控制,有效成份易受破壞,收率低。矽膠層析法用矽膠做吸附劑,一次性使用,用量大,成本高,裝柱困難,而且分離時間長,分離效果差,溶劑用量大。超臨界法速度快,效率高,但投資高。
利用植物組織培養來生產青篙素是青篙素研究的另一熱點,可能成為大規模生產青篙素的重要手段。自80年代以來,植物組織培養生產青篙素的研究工作已進行不少,已經在青篙愈傷組織、懸浮細胞、芽和毛狀根等培養體系中進行了青篙素合成的探索。
檢測
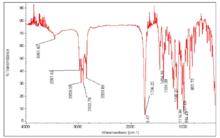 昆明地區青篙素標準品紅外光譜圖
昆明地區青篙素標準品紅外光譜圖 青蒿素紅外光譜特徵吸收峰為在1740cm-1的六元環內酯和881、995、1115cm-1的過氧基鍵。不含碳碳雙鍵。青蒿素紫外吸收很弱,只在其末端(203 nm)有弱吸收,且沒有螢光發射團,也沒有衍生化基團。因此它的定量分析有一定的難度 。
藥理作用
與以往的抗瘧藥物不同,青蒿素抗瘧機理的主要作用是通過對瘧原蟲表膜線粒體等的功能進行干擾,首先作用於食物泡膜、表膜、線粒體,其次作用於核膜、內質網,對核內染色質也有一定的影響,最終導致蟲體結構的全部瓦解,而不是藉助於干擾瘧原蟲的葉酸代謝。其作用機制也可能主要是干擾表膜一線粒體的功能,作用於食物泡膜,阻斷營養攝取的最早階段,使瘧原蟲較快出現胺基酸飢餓,從而迅速形成自噬泡並不斷排出於蟲體外,瘧原蟲最終損失大量細胞質而死亡。具體藥理作用分兩步:第一步是活化,青蒿素被瘧原蟲體內的鐵催化,其結構中的過氧橋裂解,產生自由基;第二步是烷基化,第一步所產生的自由基與瘧原蟲蛋白發生絡合,形成共價鍵,使瘧原蟲蛋白失去功能死亡 。
臨床套用
以青蒿素類藥物為主的聯合療法已經成為世界衛生組織推薦的抗瘧疾標準療法。世衛組織認為,青蒿素聯合療法是當下治療瘧疾最有效的手段,也是抵抗瘧疾耐藥性效果最好的藥物,而中國作為抗瘧藥物青蒿素的發現方及最大生產方,在全球抗擊瘧疾進程中發揮了重要作用。尤其在瘧疾重災區非洲,青蒿素已經拯救了上百萬生命。根據世衛組織的統計數據,自2000年起,撒哈拉以南非洲地區約2.4億人口受益於青蒿素聯合療法,約150萬人因該療法避免了瘧疾導致的死亡。在西非的貝寧,當地民眾都把中國醫療隊給他們使用的這種療效明顯、價格便宜的中國藥稱為“來自遙遠東方的神藥” 。
此外青篙素在其他疾病的治療中也顯示出誘人的前景。如抗血吸蟲、調節或抑制體液的免疫功能、提高淋巴細胞的轉化率,利膽,祛痰,鎮咳,平喘等。已研製出了第二代換代產品和用青篙素治療腫瘤、黑熱病、紅斑狼瘡等疾病的衍生新藥,同時開始探索青篙素治療愛滋病、惡性腫瘤、利氏曼、血吸蟲、滌蟲、弓形蟲等疾病以及戒毒的新用途。
抗瘧疾
青蒿素是繼乙氨嘧啶、氯喹、伯喹之後最熱門的抗瘧特效藥,尤其是對於腦型瘧疾和抗氯喹瘧疾,青蒿素具有速效和低毒的特點。其抗瘧疾作用機理主要在於在治療瘧疾的過程通過青蒿素活化產生自由基,自由基與瘧原蛋白結合,作用於瘧原蟲的膜繫結構,使其泡膜、核膜以及質膜均遭到破壞,線粒體腫脹,內外膜脫落,從而對瘧原蟲的細胞結構及其功能造成破壞,且細胞核內的染色質也受到一定的影響。青蒿素還能使瘧原蟲對異亮氨酸的攝入量明顯減少,從而抑制蟲體蛋白質的合成 。
青蒿素的抗瘧疾作用與不同的氧氣壓力有關,氧氣壓力越高,青蒿素對於體外培養的惡性瘧原蟲的半數有效濃度會降低。活性氧不僅可以直接對瘧原蟲起到破壞的作用,而且會損壞紅細胞,從而導致瘧原蟲死亡。黃花蒿除了對瘧原蟲有很好的殺滅作用外,對其他寄生蟲也有一定的抑制作用。20世紀80年代初,經科研人員初步研究發現,青蒿素具有抗血吸蟲的作用,研究證實,在整個服用青蒿素藥物階段對幼蟲期的血吸蟲都能產生殺滅作用。臨床證實,青蒿素及其衍生物在治療瘧疾的過程中,並沒有發現特別明顯的不良反應 。
抗腫瘤
青蒿素的抗腫瘤作用逐漸被人們發現。青蒿素能夠致使乳腺癌細胞、肝癌細胞、宮頸癌細胞等多種癌細胞的凋亡,對癌細胞的生長具有顯著的抑制作用。青蒿素及其衍生物的抗腫瘤作用主要是依靠誘導細胞的凋亡而實現的。研究發現,青蒿素是通過誘導細胞的凋亡而殺滅腫瘤細胞的。雙氫青蒿素可以通過增加活性氧,從而抑制激活缺氧誘導的相關因子,發揮出選擇性細胞毒作用。青蒿球酯對人的大腸癌細胞也有一定的抑制作用,研究發現,青蒿琥酯對人的大腸癌細胞的增值抑制作用和凋亡促進作用存在劑量依賴性。線粒體是細胞凋亡的放大器和感受器,調節控制著細胞的代謝活動,線粒體的膜電位誘導細胞的凋亡。青蒿素作用於白血病細胞的細胞膜,改變細胞膜的通透性,使得細胞內的鈣離子濃度升高,這樣不僅使得鈣蛋白酶得以激活,使其膨脹死亡,而且促進了凋亡物質的釋放,細胞凋亡加快 。
免疫調節
研究發現,青蒿素及其衍生物的使用劑量在不會引起細胞毒性的情況下,能夠較好的抑制T淋巴細胞絲裂原,從而誘導小鼠脾臟淋巴細胞的增殖。這一發現對於治療T淋巴細胞所介導的自身免疫性疾病,有很好的參考價值。青蒿玻醋具有增強非特異性免疫的作用,能夠使小鼠血清的總補體活性提高。雙氫青蒿素對於B淋巴細胞的增殖,能起到直接的抑制作用,從而減少B淋巴細胞對自身抗體的分泌,減輕體液免疫反應,對體液免疫有一定的抑制作用,減少了免疫複合物的形成 。
抗真菌
青蒿素的抗真菌作用也使得青蒿素表現出了一定的抗菌活性。研究證實青蒿素的渣粉劑和水煎劑對炭疽桿菌、表皮葡萄球菌、卡他球菌、白喉桿菌均有較強的抑菌作用,對結核桿菌、綠膿桿菌、金黃色葡萄球菌、痢疾桿菌等也具有一定的抑菌作用 。
其他套用
青蒿素在臨床上還具有與冬蟲夏草合用,可以抑制狼瘡腎炎的復發,以達到保護腎臟的功效。其抗纖維化作用,能夠顯著降低肺組織的纖維化程度,對於瘢痕的預防和治療有較好的實用前景 。
另外,青蒿素還可以破壞卡氏肺孢子蟲膜繫結構,引起孢子蟲滋養體胞漿及包囊內出現空泡,線粒體腫脹,核膜破裂,內質網腫脹,囊內小體溶解破壞等超微結構的改變,從而抗卡氏肺孢子蟲肺炎。青蒿素類藥對胚胎有較高的選擇性毒性,較低劑量即可使胚胎死亡而導致流產,有可能被開發為人工流產藥物 。
2016年12月1日,線上發表於美國Cell(《細胞》)雜誌上的一項研究表明,這一藥物或許還可以拯救糖尿病患者。來自奧地利科學院CeMM分子醫學研究中心等機構的科學家發現,青蒿素能夠讓產生胰高血糖素的 細胞“變身”產生胰島素的細胞。青蒿素結合了一個稱為gephyrin的蛋白。Gephyrin能夠激活細胞信號的主要開關——GABA受體。隨後,無數的生物化學反應發生變化,導致了胰島素的產生。另一項研究表明,在小鼠模型中,注射GABA也能導致 細胞轉化為 細胞,表明兩種物質靶向了相同的機制。但青蒿素的長期作用需要進一步測試 。
用法用量
①控制瘧疾症狀(包括間日瘧與耐氯喹惡性瘧),青蒿素片劑首次 1.0g,6~8h後0.5g,第 2、3日各0.5g。栓劑首次 600mg,4h後 600mg,第 2、3日各 400mg。
②惡性腦型瘧,青蒿素水混懸劑,首劑 600mg,肌注,第 2、3日各肌注 150mg。
③系統性紅斑狼瘡或盤狀紅斑狼瘡,第 1個月每次口服 0.1g,1日 2次,第 2個月每次0.1g,每日3次,第 3個月每次 0.1g,每日 4次。
直腸給藥,1次 0.4~0.6g, 1日 0.8~1.2g。
深部肌注,首次200mg,間隔6~8小時後再肌注100mg,第二、三日各肌注100mg,總量500mg;肌注300mg/日,連用3日,總量900mg。小兒15mg/kg,按上述方法3日內注完。
口服,首次服1g,間隔6~8小時後再服0.5g,第二、三日各服0.5g,3日為1療程 。
副作用及不良反應
1.有輕度噁心、嘔吐及腹瀉等,不加治療能很快恢復正常。
2.注射部位淺時,易引起局部疼痛和硬塊。
3.個別病人,可出現一過性轉氨酶升高及輕度皮疹。
使用注意事項
1.本藥為瘧疾治療藥,不作預防藥使用。
2.注射劑如注射部位較淺,易引起局部疼痛及硬結。
3.用於治療系統性紅斑狼瘡及盤狀紅斑狼瘡時,在治療初期病情可能有所加重(全身出現蟻走感),半個月後逐漸減輕,約一月後一般可得到改善。
4.採用栓劑時,如塞肛後2小時內排便,應補用1次 。
藥品分類導航
| 根據《中華人民共和國藥品管理法》第一百零二條關於藥品的定義:藥品是指用於預防、治療、診斷人的疾病,有目的地調節人的生理機能並規定有適應症或者功能主治、用法和用量的物質,包括中藥材、中藥飲片、中成藥、化學原料藥及其製劑、抗生素、生化藥品、放射性藥品、血清、疫苗、血液製品和診斷藥品等。 | |||
| 藥物大全 | 抗生素藥品 | 胰島素 | |
| 化學藥品 | 藥品安全 | 食品安全事件 | |
抗寄生蟲病藥物盤點
| 抗瘧藥是用於預防或治療瘧疾的藥物。瘧疾是由瘧原蟲引發的一種寄生蟲傳染病,致病瘧原蟲主要有間日瘧原蟲、三日瘧原蟲、和惡性瘧原蟲,分別引起間日瘧、三日瘧和惡性瘧。 |