簡介
 肌球蛋白
肌球蛋白肌肉的主要組成蛋白質,占肌原纖維總蛋白質的60%。分子量約48萬,是150毫微米長的棒狀分子,一端有兩個頭部。由兩條分子量約20萬的H鏈和四條分子量約1萬7千到2萬5千的L鏈組成。用蛋白分解酶處理可分割為頭部(H-酶解肌球蛋白)和尾部(L-酶解肌球蛋白)。在0.6M KCl溶液中分散成單體,但在0.2M以下的KCl溶液中可形成締合體,自動聚集成1―2微米長的和A絲相似的結構。在肌原纖維內形成長1.5微
米寬10―15毫微米的A絲。頭部向外側突出架成橋。頭部的方向表現為鉗在絲的中央部而向相反的方向伸展,結果可以在絲的中央部300毫微米處看到沒有頭部的裸露部分。頭部在A絲上每彎14.3毫微米就移出120°和I絲對應,周期為42.9毫微米。肌球蛋白具有ATP酶活性,在低離子強度下,和肌動蛋白反應,而引起超沉澱,且肌動蛋白能促進ATP酶活性。ATP酶活性和肌動蛋白的反應,表現於頭部的活性基團,可以認為這一部分一面分解ATP,一面進行振頭活動,把I絲拉向A絲的中央部。肌球蛋白的L鏈對ATP酶活性具有重要的作用(參見肌球蛋白L鏈)。肌球蛋白和肌動蛋白一起被認為與全部細胞運動有關,也可從腦、粘菌、海膽卵等分離出來。肌球蛋白是由森特・吉奧爾吉(A・Szent-Gyrgyi,1942)分離出來的,但是相當於現在所說的肌動球蛋白物質是庫恩(W.Khne,1859)最初從蛙抽提出來的,並被命名為肌球蛋白。肌球蛋白的ATP酶活性是由蘇聯的V.A.Engelhardt夫婦(1939)發現的。
還有非肌肉型肌球蛋白。
結構
 肌球蛋白
肌球蛋白肌球蛋白是長形不對稱分子,形狀如“Y”字,長約160nm。電子顯微鏡下觀察到它含有兩條完全相同
的長肽鏈和兩對短肽鏈,組成兩個球狀頭部和一個長桿狀尾部。肌球蛋白分子量約460kD,長肽鏈的分子量約240kD,稱重鏈;短鏈稱輕鏈。將肌肉肌球蛋白用5,5′-二硫雙(α-硝基苯甲酸,DTNB)處理後放出的一對輕鏈,稱為DTNB鏈,分子量約18kD;另兩條輕鏈只有在鹼性(pH 11.4)條件下才能分離出來,稱鹼性輕鏈,分子量分別為25kD和16kD。非肌細胞如粘菌的肌球蛋白的形狀和結構與肌細胞的肌球蛋白非常相似,但它不存在DTNB鏈,兩對不同的輕鏈稱必需輕鏈(essential light chain)和調節輕鏈(regulatory light chain),分子量分別為16kD和18kD。閻隆飛等於1963年首次從菸草微管束中分離出肌動球蛋白,證明其具有ATP酶活性,這是高等植物中存在肌動蛋白和肌球蛋白的第一個證據。馬永澤和閻隆飛(1989)證明,豌豆葉片的卷鬚中存在肌球蛋白,SDS-PAGE測得兩條重鏈的分子量為165kD,兩對輕鏈的分子量分別為17kD和15kD。
性能介紹
性質
肌球蛋白屬球蛋白類,不溶於水而溶於0.6mol/ml的KCl或NaCl溶液。它具有酶活性,通過與肌動蛋白相互作用,水解ATP的末端磷酸基團,同時也能水解GTP、CTP等,將化學能轉化為機械能,從而產生各種形式的運動。物理化學研究表明,肌球蛋白溶液加入ATP後,其粘度和流動雙折射顯著下降。後來證實這是由於肌動蛋白與肌球蛋白複合物的分解,形成兩種軸比較小的蛋白質分子而引起。
功能
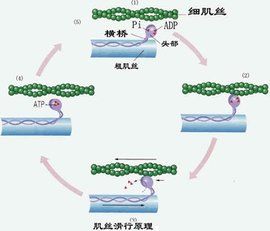
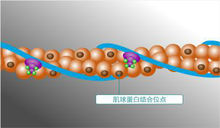
肌球蛋白作為細胞骨架的分子馬達,是一種多功能蛋白質,其主要功能是為肌肉收縮提供力。纖絲滑動學說(sliding filament theory)認為肌肉收縮是由於肌動蛋白細絲與肌球蛋白絲相互滑動的結果。在肌肉收縮過程中,粗絲和細絲本身的長度都不發生改變,當纖絲滑動時,肌球蛋白的頭部與肌動蛋白的分子發生接觸(attachment)、轉動(tilting),最後脫離(detachment)的連續過程,其結果使細絲進行相對的滑動。
 肌球蛋白
肌球蛋白肌球蛋白也廣泛存在於非肌細胞中,它是細胞骨架的組成成分,為細胞質流動、細胞器運動、物質運輸、有絲分裂、胞質分裂和細胞的頂端生長等提供所需的力,參與細胞的吞噬、運動、受精和吸收
等生理過程,充當非肌細胞生命活動的不同層次的調節者,從簡單的細胞間的信號傳遞到指導向化性遷移和細胞形狀的改變等較高級的調節。研究表明,肌球蛋白為盤基網柄菌在振盪培養下正常生長和分裂、表面蛋白受體成帽(surface receptor capping)、多細胞發育成子實體(fruiting body)、細胞與器壁的脫粘附(adherence)等生命活動所必需。閻隆飛等在80年代的研究結果表明,肌球蛋白在高等植物如黃瓜等花粉管伸長和豌豆葉片卷鬚運動中可能執行重要功能。Kinkema等(1994)證明植物肌球蛋白在植物生長發育的不同時期及不同部位有不同的生理功能。