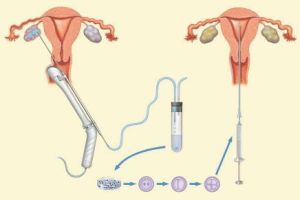
技術發展
20世紀60年代初至20世紀80年代中期,人們以家兔、小鼠和大鼠等為實驗材料,進行了大量基礎研究,在精子獲能機理和獲能方法方面取得很大進展。精子由最初在同種或異種雌性生殖道孵育獲能,發展到用子宮液、卵泡液、子宮內膜提取液或血清等在體外培養獲能,最後用化學成分明確的溶液培養獲能。同時,通過射出精子和附睪精子獲能效果的比較研究,人們發現射出精液中含有去能因子,並認識到獲能的實質是去除精子表面的去能因子。這些理論和方法上的成就,推動了體外受精技術的發展,試管小鼠(Whit-tingham,1968)、大鼠(Toyoda和Chang,1974)、嬰兒(Steptoe和Edwards,1978)、牛(Brackett等,1982)、山羊(Hamda,1985)、綿羊(Hanada,1985)和豬(Chang等,1986)等相繼出生。IVF技術
 IVF技術
IVF技術技術套用
牛的體外受精技術不僅套用於畜牧生產,同時,也成為研究其他胚胎生物技術,如克隆、轉基因、胚胎幹細胞分離培養和性別控制等的重要輔助手段。動物程式
卵母細胞的採集和成熟培養
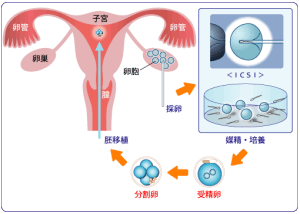 體外受精
體外受精(1)超數排卵:雌性動物用促卵泡素和促黃體素處理後,從輸卵管中沖取成熟卵子可直接與獲能精子受精。在大家畜中,由於操作程式複雜,成本較高,很少使用。這種方法的關鍵是掌握卵子進入輸卵管和卵子在輸卵管中維持受精能力的時間,一般要求在卵子具有旺盛受精力之前沖取。
(2)從活體卵巢中採集卵母細胞:這種方法是藉助超音波探測儀、內窺鏡或腹腔鏡直接從活體動物的卵巢中吸取卵母細胞。
在家畜中,牛和馬等大家畜常用超音波探測儀輔助取卵,其方法是用手從直腸把握卵巢,經陰道壁穿刺插入吸卵針,藉助B型超音波圖像引導,吸取大卵泡中的卵母細胞。按照目前的技術水平,一頭健康母牛每周可獲得5~10枚卵子。在家畜中,活體採集的卵母細胞一般要經成熟培養後才能與精子受精。這種方法對擴繁優良母畜具有重大意義,在有些國家已用於商業化生產。
(3)從屠宰後母畜卵巢上採集卵母細胞:這種方法是從剛屠宰母畜體內摘出卵巢,經洗滌、保溫(30℃~37℃)後,快速運到實驗室,在無菌條件下用注射器或真空泵抽吸卵巢表面一定直徑卵泡中的卵母細胞(牛卵泡直徑要求3-10mm)也可對卵巢進行切片,收集卵母細胞。用此方法獲得的卵母細胞多數處於生髮泡期(GV期),需要在體外培養成熟後才能與精子受精。從廢棄卵巢中採集卵母細胞的關鍵是注意卵巢的保溫和防止細菌污染。因此卵巢從畜體摘取後須放入含有生理鹽水或磷酸緩衝液(PBS)的保溫瓶中;吸卵前卵巢要用生理鹽水或PBS多次洗滌;所用溶液都要添加抗生素。
這種方法的最大優點是材料來源豐富,成本低廉,但確定母畜的系譜困難。
2.母細胞的選擇:
採集的卵母細胞絕大部分與卵丘細胞形成卵丘卵母細胞複合體(cumulusoocytecomplesxCOC)。無論採用何種方法,採集的COC都要求卵母細胞形態規則,細胞質均勻,外圍有多層卵丘細胞緊密包圍。在家畜體外受精研究中,常把未成熟卵母細胞分為A、B、C和D四個等級。A級卵母細胞要求有三層以上卵丘細胞緊密包圍,細胞質均勻;B級要求卵母細胞質均勻,卵丘細胞層低於三層或部分包圍卵母細胞;C級為沒有卵丘細胞包圍的裸露卵母細胞;D級是死亡或退化的卵母細胞。在體外受精實踐中,一般只培養A級和B級卵母細胞。
3.卵母細胞的成熟培養:
由超數排卵採集的卵母細胞已在體內發育成熟,不需培養可直接與精子受精,對未成熟卵母細胞需要在體外培養成熟。培養時,先將採集的卵母細胞在實體顯微鏡經過挑選和洗滌後,然後放入成熟培養液中培養。家畜卵母細胞的成熟培養液目前普遍採用TCM199添加孕牛血清、促性腺激素、雌激素和抗生素成份。通常採用微滴培養法,微滴體積為50-200微升,每滴中放入的卵母細胞數按每5微升一個計算單位。卵母細胞移入小滴後,放入二氧化碳培養箱中培養,培養條件為39℃、100%濕度和5%二氧化碳的空氣。牛的培養時間為20-24小時,卵丘卵母細胞複合體經成熟培養後,卵丘細胞層擴散靠近卵母細胞周圍的卵丘細胞呈放射狀排列,出現放射冠,用DNA特意性染料染色後,在顯微鏡下進行核相觀察,可見卵母細胞處於第2次成熟分裂中期。
體外受精
1.精子的獲能處理:哺乳動物精子的獲能方法有培養和化學誘導兩種方法。牛、羊的精子常用化學藥物誘導獲能,誘導獲能的藥物常用肝素和鈣離子載體。2.受精:即獲能精子與成熟卵子的共培養,除鈣離子載體誘導獲能外,精子和卵子一般在獲能液中完成受精過程。受精培養時間與獲能方法有關。在B2液中一般為6-8小時而用TALP或S.F液作受精液時可培養18~24h。精子和卵子常在小滴中共培養,受精時精子密度為1~9×106/ml,每10微升精液中放人1~2枚卵子,小滴體積一般為50~200微升。
胚胎培養
精子和卵子受精後,受精卵需移入發育培養液中繼續培養以檢查受精狀況和受精卵的發育潛力,質量較好的胚胎可移入受體母畜的生殖道內繼續發育成熟或進行冷凍保存。提高受精卵發育率的關鍵因素是選擇理想的培養體系。在家畜中,胚胎培養液分為複雜的和化學成分明確的培養液兩大類。複雜培養液中的成分很多,除無機和有機鹽外,還添加維生素、胺基酸、核苷酸和嘌呤等營養成分和血清,最常用的有TCM199、B2和F10。用它們培養胚胎時,可以採用體細胞共培養體系,即體細胞與胚胎在微滴中共同培養,利用體細胞生長過程中分泌的有益因子,促進胚胎髮育,克服發育阻斷。
受精卵的培養廣泛採用微滴法,胚胎與培養液的比例為一枚胚胎用3~10微升培養液;一般5~10枚胚胎放在一個小滴中培養以利用胚胎在生長過程中分泌的活性因子,相互促進發育。胚胎培養條件與卵母細胞成熟培養條件相同。有的實驗室採用88%N2、7%O2和5%二氧化碳混合氣體培養,以降低培養液中氧自由基濃度,提高胚胎髮育率。胚胎在培養過程中要求每48-72小時更換一次培養液,同時觀察胚胎的發育狀況。當胚胎髮育到一定階段時可進行胚胎移植或冷凍保存,牛、羊受精卵通常培養到緻密桑椹胚或囊胚時進行移植或冷凍保存。
技術問題
發展現狀
家畜體外受精技術經過近20年的發展,已取得很大進展,其中牛的IVF水平最高,入孵卵母細胞(即進入成熟培養)的卵裂率為80%~90%,受精後第七天的囊胚發育率為40%~50%,囊胚超低溫冷凍後繼續發育率為80%,移植後的產犢率為30%~40%.平均每個卵巢可獲得A級卵母細胞10個左右,經體外受精可獲得3~4個囊胚,移植後產犢1~2頭。存在的問題
(1)囊胚發育率低,細胞數少。體外受精卵在培養過程中普遍存在發育阻斷(developmental block),即胚胎髮育到一定階段後停止發育並發生退化的現象。牛胚胎阻斷髮生在8~16細胞階段,這就導致體外受精卵的囊胚發育率遠低於體內受精。此外,與體內受精囊胚相比,體外受精囊胚的細胞總數和內細胞團細胞數明顯減少。(2)產犢率低,胎兒初生重高。家畜體外受精胚胎,特別是牛的IVF胚胎移人受體後,產犢率比體內受精低15%~20%,但胎兒初生重比人工授精後代高3~4kg,導致受體母畜難產率高。
存在的風險
以目前的技術,除了極少部份人可能在胚胎植入後約一周左右會出現卵巢過度刺激綜合症外(暫時性的腹脹,少尿,口渴,腹水等症狀),幾乎無任何副作用。但通常出現卵巢過度刺激綜合症這些人的懷孕率特別高(據統計如果有中等程度之過度刺激綜合症出現者,其懷孕率可達86%[來源請求]),而其不舒服的症狀約二周就會自然消失。發展方向
(1)深入研究卵母細胞成熟和胚胎髮育的分子機理體外受精效率低的主要原因是人們對卵子發生和胚胎髮育的分子機理了解不夠。大幅度提高IVF效率的前提是探明卵母細胞和早期胚胎髮育的分子調控機理,然後以此理論為指導,研究理想的培養體系,促使胚胎基因組得到穩定、有序表達。
(2)加強腔前卵泡培養的研究,利用優良母畜的遺傳資源目前IVF技術利用的卵母細胞不足家畜卵巢上卵母細胞總數的千分之一。為此,一方面提高活體取卵技術,另一方面需研究腔前卵泡和小卵泡的體外成熟技術。為保證卵母細胞的穩定來源及良種母畜或瀕危動物的保種,卵泡和卵母細胞的超低溫冷凍保存技術的研究也必須加強。
(3)加強體外受精與其他生物技術的結合。體外受精與轉基因、克隆、性別控制及胚胎幹細胞的培養密不可分。通過體外受精可為外源基因的導人提供充足的胚胎來源;為克隆技術提供成熟卵母細胞和克隆胚胎的培養體系;用分離的X和Y精子與卵子體外受精,可對哺乳動物進行性別控制。同樣,胚胎幹細胞的分離也需要IVF技術提供胚胎和培養體系。這些生物技術的綜合發展將對人類生活產生重大影響。
相關內容
輔助受精技術(Techniques f.r assisted fertilizati.n)是IVF的延伸,它是通過人為方法使精子和卵子完成受精過程,克服在某些情況下精子不能穿過透明帶和卵黃膜的缺陷。這項技術起源於20世紀60年代,20世紀80年代得到迅速發展,在醫學上已成為治療某些男性不育症的主要措施之一;在基礎生物學中,它對研究哺乳動物受精和發育機理有很重要的價值;它還對挽救瀕危動物和充分利用優良種公畜等有重要意義。目前哺乳動物的輔助受精技術有透明帶修飾和精子注人兩種方法。由於兩種方法都需要藉助顯微操作儀來完成,所以又稱輔助受精技術為顯微授精(microinsemination)。
(一)透明帶修飾法:它是運用物理或化學方法對卵母細胞的透明帶進行打孔、部分切除或撕開缺口,為精子進入卵黃周隙打開通道,然後把卵子與一定濃度的精子共培養以完成受精過程.這種方法適用於具有一定運動能力,但頂體反應不全,無法穿過透明帶的精子。它的優點是對卵子的損傷小,但對於靠透明帶反應阻止多精入卵的動物易造成多精子受精,影響胚胎繼續發育。目前這種方法僅在小鼠中取得成功。
(二)精子注入法:它是利用顯微操作儀直接把精子注入卵黃周隙或卵母細胞的胞質中,前者稱透明帶下授精(subzonal inseminatiom SUZI),後者稱胞質內精子注射(intracytoplasmic sperm injection,ICSI)。透明帶下授精對注入的精子數有嚴格要求:具有活力且已發生頂體反應的精子要單個注入;沒有發生頂體反應的精子,注入的數目可加大。SUZI的優點是對卵母細胞的損傷小,已在臨床醫學上得到運用,但多精入卵是制約這一技術發展的主要原因。胞質內精子注射對精子活力、形態和頂體反應沒有特殊要求,只需注入單個精子即可,為提高受精率,注射後卵子需要人為激活。胞質內注射精子作為治療男性受精障礙症的方法已在許多國家得以套用,由此獲得的試管嬰兒數已超過3000例。
存在問題
一、發展現狀:
家畜體外受精技術經過近20年的發展,已取得很大進展,其中牛的IVF水平最高,入孵卵母細胞(即進入成熟培養)的卵裂率為80%~90%,受精後第七天的囊胚發育率為40%~50%,囊胚超低溫冷凍後繼續發育率為80%,移植後的產犢率為30%~40%.平均每個卵巢可獲得A級卵母細胞10個左右,經體外受精可獲得3~4個囊胚,移植後產犢1~2頭。
二、存在的問題和發展方向
1.存在的問題
(1)囊胚發育率低,細胞數少。體外受精卵在培養過程中普遍存在發育阻斷(developmentalblock),即胚胎髮育到一定階段後停止發育並發生退化的現象。牛胚胎阻斷髮生在8~16細胞階段,這就導致體外受精卵的囊胚發育率遠低於體內受精。此外,與體內受精囊胚相比,體外受精囊胚的細胞總數和內細胞團細胞數明顯減少。
(2)產犢率低,胎兒初生重高。家畜體外受精胚胎,特別是牛的IVF胚胎移人受體後,產犢率比體內受精低15%~20%,但胎兒初生重比人工授精後代高3~4kg,導致受體母畜難產率高。
2.發展方向
(1)深入研究卵母細胞成熟和胚胎發育的分子機理體外受精效率低的主要原因是人
們對卵子發生和胚胎髮育的分子機理了解不夠。大幅度提高IVF效率的前提是探明卵母細胞和早期胚胎髮育的分子調控機理,然後以此理論為指導,研究理想的培養體系,促使胚胎基因組得到穩定、有序表達.
(2)加強腔前卵泡培養的研究,利用優良母畜的遺傳資源目前IVF技術利用的卵母細胞不足家畜卵巢上卵母細胞總數的千分之一。為此,一方面提高活體取卵技術,另一方面需研究腔前卵泡和小卵泡的體外成熟技術。為保證卵母細胞的穩定來源及良種母畜或瀕危動物的保種,卵泡和卵母細胞的超低溫冷凍保存技術的研究也必須加強。
(3)加強體外受精與其他生物技術的結合。體外受精與轉基因、克隆、性別控制及胚胎幹細胞的培養密不可分。通過體外受精可為外源基因的導人提供充足的胚胎來源;為克隆技術提供成熟卵母細胞和克隆胚胎的培養體系;用分離的X和Y精子與卵子體外受精,可對哺乳動物進行性別控制。同樣,胚胎幹細胞的分離也需要IVF技術提供胚胎和培養體系。這些生物技術的綜合發展將對人類生活產生重大影響。
輔助受精
輔助受精技術(Techniquesf.rassistedfertilizati.n)是IVF的延伸,它是通過人為方法使精子和卵子完成受精過程,克服在某些情況下精子不能穿過透明帶和卵黃膜的缺陷。這項技術起源於20世紀60年代,20世紀80年代得到迅速發展,在醫學上已成為治療某些男性不育症的主要措施之一;在基礎生物學中,它對研究哺乳動物受精和發育機理有很重要的價值;它還對挽救瀕危動物和充分利用優良種公畜等有重要意義。目前哺乳動物的輔助受精技術有透明帶修飾和精子注人兩種方法。由於兩種方法都需要藉助顯微操作儀來完成,所以又稱輔助受精技術為顯微授精(microinsemination)。
(一)透明帶修飾法:它是運用物理或化學方法對卵母細胞的透明帶進行打孔、部分切除或撕開缺口,為精子進入卵黃周隙打開通道,然後把卵子與一定濃度的精子共培養以完成受精過程.這種方法適用於具有一定運動能力,但頂體反應不全,無法穿過透明帶的精子。它的優點是對卵子的損傷小,但對於靠透明帶反應阻止多精入卵的動物易造成多精子受精,影響胚胎繼續發育。目前這種方法僅在小鼠中取得成功。
(二)精子注入法:它是利用顯微操作儀直接把精子注入卵黃周隙或卵母細胞的胞質中,前者稱透明帶下授精(subzonalinseminatiomSUZI),後者稱胞質內精子注射(intracytoplasmicsperminjection,ICSI)。透明帶下授精對注入的精子數有嚴格要求:具有活力且已發生頂體反應的精子要單個注入;沒有發生頂體反應的精子,注入的數目可加大。SUZI的優點是對卵母細胞的損傷小,已在臨床醫學上得到運用,但多精入卵是制約這一技術發展的主要原因。胞質內精子注射對精子活力、形態和頂體反應沒有特殊要求,只需注入單個精子即可,為提高受精率,注射後卵子需要人為激活。胞質內注射精子作為治療男性受精障礙症的方法已在許多國家得以套用,由此獲得的試管嬰兒數已超過3000例。