定義
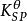 溶度積常數
溶度積常數沉澱在溶液中達到沉澱溶解平衡狀態時,各離子濃度保持不變( 或一定) ,其離子濃度冪的乘積為一個常數,這個常數稱之為溶度積常數,簡稱溶度積,用表示.
來源
在一定的的溫度下,將難溶的強電解質放入水中,就會發生沉澱和溶解兩個過程。例如:將硫酸鋇放入水中,硫酸鋇是由硫酸根離子和鋇離子組成的晶體,將其放入水中,晶體中的鋇離子和硫酸根離子在水分子的作用下,不斷地由晶體表面進入到水中,成為無規則運動的水合離子,這就是硫酸鋇晶體的溶解過程;同時,已經溶解在溶液里的硫酸根離子和鋇離子在不斷運動中相互碰撞或者與未溶解硫酸鋇表面碰撞,以固體硫酸鋇的形式析出,這是硫酸鋇的沉澱過程。任何難溶電解質的沉澱和溶解過程都是相互可逆的。開始時,溶解速率較大,沉澱速率較小,在一定的條件下,沉澱溶解的速率相等時,此時建立起了多相離子的平衡狀態。此時動態平衡的標準平衡常數表達式為:
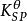 溶度積常數
溶度積常數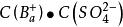 溶度積常數
溶度積常數=
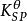 溶度積常數
溶度積常數對於一般的化學反應 AnBm(s=nA(aq)+ mB(aq), 溶度積=C(A)^n×C(B)^m
溶度積常數等於沉澱溶解平衡時,離子濃度冪的乘積,每種離子濃度的冪等於化學計量式的計量數。
溶解度和溶度積的互相換算
1、已知溶度積 , 計算溶解度 S
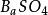 溶度積常數
溶度積常數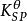 溶度積常數
溶度積常數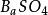 溶度積常數
溶度積常數例、已知在298.15K時的溶度積為,求在298.15K時的溶解度。
解:設BaSO4的溶解度( S)為 x mol·L
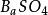 溶度積常數
溶度積常數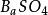 溶度積常數
溶度積常數因為難溶強電解質,且鋇離子,硫酸根離子基本上不水解,所以在飽和溶液中:
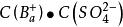 溶度積常數
溶度積常數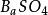 溶度積常數
溶度積常數= C()
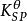 溶度積常數
溶度積常數x· x =
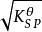 溶度積常數
溶度積常數 溶度積常數
溶度積常數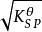 溶度積常數
溶度積常數S = x =,換算單位S = M g/L
(1)AB型難溶強電解質 計算結果表明:對於基本上不水解的AB型難溶強電解質,其溶解度( S )在數值上等於其溶度積的平方根與摩爾質量之積。即:
 溶度積常數
溶度積常數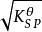 溶度積常數
溶度積常數S =M
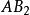 溶度積常數
溶度積常數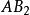 溶度積常數
溶度積常數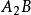 溶度積常數
溶度積常數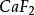 溶度積常數
溶度積常數(2)型難溶強電解質 同時可推導出(或)型難溶電解質(如等)其溶度積和溶解度的關係為:
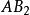 溶度積常數
溶度積常數c(A) c(B)= ()( c)
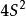 溶度積常數
溶度積常數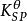 溶度積常數
溶度積常數S×(2 S)==
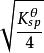 溶度積常數
溶度積常數 溶度積常數
溶度積常數所以: S =M
 溶度積常數
溶度積常數也近似地適用於微弱水解的AB型、A2B(或AB2)型難溶強電解質。如、AgCl、AgBr、AgI等,但不適用於易水解的難溶電解質(如ZnS)和難溶弱電解質及在溶液中易以離子對形式存在的難溶電解質。
2、已知溶解度 S , 計算溶度積 ( S → )
與 上面所述是可逆過程, 只要列出與 S 的關係式, 即能求解。
異同
1.兩者都可以用來表示難溶電解質的溶解性大小。
2.溶度積是難溶解的固相與溶液中相應離子達到平衡時的離子濃度的乘積,只與溫度有關。
溶解度不僅與溫度有關,還與系統的組成,PH的改變,配合物的生成等因素有關。
3.
| 類型 | 化學式 | 溶度積(mol/L) | 溶解度(g/L) |
| AB | AgCl | 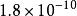 溶度積常數 溶度積常數 | 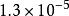 溶度積常數 溶度積常數 |
| AB | AgBr | 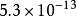 溶度積常數 溶度積常數 | 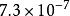 溶度積常數 溶度積常數 |
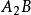 溶度積常數 溶度積常數 | 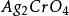 溶度積常數 溶度積常數 | 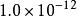 溶度積常數 溶度積常數 | 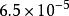 溶度積常數 溶度積常數 |
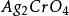 溶度積常數
溶度積常數可以看出,氯化銀的溶度積大於溴化銀,同時溶解度也大;但是,氯化銀的溶度積大於,溶解度反而小。這是因為兩者的化學式不同,換算關係也不同導致的。因此,只有同一個類型的難溶電解質才可以通過溶度積比較溶解度。
溶度積規則
與離子積的關係
離子積IP(ion product):任一條件下離子濃度冪的乘積。Ksp表示難溶電解質的飽和溶液中離子濃度冪的乘積,僅是IP的一個特例。
數值分析
1. IP=Ksp 表示溶液是飽和的。這時溶液中的沉澱與溶解達到動態平衡,既無沉澱析出又無沉澱溶解。
2. IP<Ksp 表示溶液是不飽和的。溶液無沉澱析出,若加入難溶電解質,則會繼續溶解。
3. IP>Ksp 表示溶液為過飽和。溶液會有沉澱析出
溶度積常數
| 難溶化合物的溶度積常數 | |||
| Solubility Products of Undissolved Compounds | |||
| 序號 | 分 子 式(Molecular formula) | Ksp | pKsp |
| (No.) | (-lgKsp) | ||
| 1 | Ag3AsO4 | 1.0×10 | 22 |
| 2 | AgBr | 5.0×10 | 12.3 |
| 3 | AgBrO3 | 5.50×10 | 4.26 |
| 4 | AgCl | 1.8×10 | 9.75 |
| 5 | AgCN | 1.2×10 | 15.92 |
| 6 | Ag2CO3 | 8.1×10 | 11.09 |
| 7 | Ag2C2O4 | 3.5×10 | 10.46 |
| 8 | Ag2Cr2O4 | 1.2×10 | 11.92 |
| 9 | Ag2Cr2O7 | 2.0×10 | 6.7 |
| 10 | AgI | 8.3×10 | 16.08 |
| 11 | AgIO3 | 3.1×10 | 7.51 |
| 12 | AgOH | 2.0×10 | 7.71 |
| 13 | Ag2MoO4 | 2.8×10 | 11.55 |
| 14 | Ag3PO4 | 1.4×10 | 15.84 |
| 15 | Ag2S | 6.3×10 | 49.2 |
| 16 | AgSCN | 1.0×10 | 12 |
| 17 | Ag2SO3 | 1.5×10 | 13.82 |
| 18 | Ag2SO4 | 1.4×10 | 4.84 |
| 19 | Ag2Se | 2.0×10 | 63.7 |
| 20 | Ag2SeO3 | 1.0×10 | 15 |
| 21 | Ag2SeO4 | 5.7×10 | 7.25 |
| 22 | AgVO3 | 5.0×10 | 6.3 |
| 23 | Ag2WO4 | 5.5×10 | 11.26 |
| 24 | Al(OH)3 | 4.57×10 | 32.34 |
| 25 | AlPO4 | 6.3×10 | 18.24 |
| 26 | Al2S3 | 2.0×10 | 6.7 |
| 27 | Au(OH)3 | 5.5×10 | 45.26 |
| 28 | AuCl3 | 3.2×10 | 24.5 |
| 29 | AuI3 | 1.0×10 | 46 |
| 30 | Ba3(AsO4)2 | 8.0×10 | 50.1 |
| 31 | BaCO3 | 5.1×10 | 8.29 |
| 32 | BaC2O4 | 1.6×10 | 6.79 |
| 33 | BaCrO4 | 1.2×10 | 9.93 |
| 34 | Ba3(PO4)2 | 3.4×10 | 22.44 |
| 35 | BaSO4 | 1.1×10 | 9.96 |
| 36 | BaS2O3 | 1.6×10 | 4.79 |
| 37 | BaSeO3 | 2.7×10 | 6.57 |
| 38 | BaSeO4 | 3.5×10 | 7.46 |
| 39 | Be(OH)2 | 1.6×10 | 21.8 |
| 40 | BiAsO4 | 4.4×10 | 9.36 |
| 41 | Bi2(C2O4)3 | 3.98×10 | 35.4 |
| 42 | Bi(OH)3 | 4.0×10 | 30.4 |
| 43 | BiPO4 | 1.26×10 | 22.9 |
| 44 | CaCO3 | 2.8×10 | 8.54 |
| 45 | CaC2O4·H2O | 4.0×10 | 8.4 |
| 46 | CaF2 | 2.7×10 | 10.57 |
| 47 | CaMoO4 | 4.17×10 | 7.38 |
| 48 | Ca(OH)2 | 5.5×10 | 5.26 |
| 49 | Ca3(PO4)2 | 2.0×10 | 28.7 |
| 50 | CaSO4 | 9.12×10-6 | 5.04 |
| 51 | CaSiO3 | 2.5×10 | 7.6 |
| 52 | CaWO4 | 8.7×10 | 8.06 |
| 53 | CdCO3 | 5.2×10 | 11.28 |
| 54 | CdC2O4·3H2O | 9.1×10 | 7.04 |
| 55 | Cd3(PO4)2 | 2.5×10 | 32.6 |
| 56 | CdS | 8.0×10 | 26.1 |
| 57 | CdSe | 6.31×10 | 35.2 |
| 58 | CdSeO3 | 1.3×10 | 8.89 |
| 59 | CeF3 | 8.0×10 | 15.1 |
| 60 | CePO4 | 1.0×10 | 23 |
| 61 | Co3(AsO4)2 | 7.6×10 | 28.12 |
| 62 | CoCO3 | 1.4×10 | 12.84 |
| 63 | CoC2O4 | 6.3×10 | 7.2 |
| 64 | Co(OH)2(藍) | 6.31×10 | 14.2 |
| Co(OH)2 (粉紅,新沉澱) | 1.58×10 | 14.8 | |
| Co(OH)2 (粉紅,陳化) | 2.00×10 | 15.7 | |
| 65 | CoHPO4 | 2.0×10 | 6.7 |
| 66 | Co3(PO4)3 | 2.0×10 | 34.7 |
| 67 | CrAsO4 | 7.7×10 | 20.11 |
| 68 | Cr(OH)3 | 6.3×10 | 30.2 |
| 69 | CrPO4·4H2O(綠) | 2.4×10 | 22.62 |
| CrPO4·4H2O(紫) | 1.0×10 | 17 | |
| 70 | CuBr | 5.3×10 | 8.28 |
| 71 | CuCl | 1.2×10 | 5.92 |
| 72 | CuCN | 3.2×10 | 19.49 |
| 73 | CuCO3 | 2.34×10 | 9.63 |
| 74 | CuI | 1.1×10 | 11.96 |
| 75 | Cu(OH)2 | 4.8×10 | 19.32 |
| 76 | Cu3(PO4)2 | 1.3×10 | 36.9 |
| 77 | Cu2S | 2.5×10 | 47.6 |
| 78 | Cu2Se | 1.58×10 | 60.8 |
| 79 | CuS | 6.3×10 | 35.2 |
| 80 | CuSe | 7.94×10 | 48.1 |
| 81 | Dy(OH)3 | 1.4×10 | 21.85 |
| 82 | Er(OH)3 | 4.1×10 | 23.39 |
| 83 | Eu(OH)3 | 8.9×10 | 23.05 |
| 84 | FeAsO4 | 5.7×10 | 20.24 |
| 85 | FeCO3 | 3.2×10 | 10.5 |
| 86 | Fe(OH)2 | 8.0×10 | 15.1 |
| 87 | Fe(OH)3 | 4.0×10 | 37.4 |
| 88 | FePO4 | 1.3×10 | 21.89 |
| 89 | FeS | 6.3×10 | 17.2 |
| 90 | Ga(OH)3 | 7.0×10 | 35.15 |
| 91 | GaPO4 | 1.0×10 | 21 |
| 92 | Gd(OH)3 | 1.8×10 | 22.74 |
| 93 | Hf(OH)4 | 4.0×10 | 25.4 |
| 94 | Hg2Br2 | 5.6×10 | 22.24 |
| 95 | Hg2Cl2 | 1.3×10 | 17.88 |
| 96 | HgC2O4 | 1.0×10 | 7 |
| 97 | Hg2CO3 | 8.9×10 | 16.05 |
| 98 | Hg2(CN)2 | 5.0×10 | 39.3 |
| 99 | Hg2CrO4 | 2.0×10 | 8.7 |
| 100 | Hg2I2 | 4.5×10 | 28.35 |
| 101 | HgI2 | 2.82×10 | 28.55 |
| 102 | Hg2(IO3)2 | 2.0×10 | 13.71 |
| 103 | Hg2(OH)2 | 2.0×10 | 23.7 |
| 104 | HgSe | 1.0×10 | 59 |
| 105 | HgS(紅) | 4.0×10 | 52.4 |
| 106 | HgS(黑) | 1.6×10 | 51.8 |
| 107 | Hg2WO4 | 1.1×10 | 16.96 |
| 108 | Ho(OH)3 | 5.0×10 | 22.3 |
| 109 | In(OH)3 | 1.3×10 | 36.9 |
| 110 | InPO4 | 2.3×10 | 21.63 |
| 111 | In2S3 | 5.7×10 | 73.24 |
| 112 | La2(CO3)3 | 3.98×10 | 33.4 |
| 113 | LaPO4 | 3.98×10 | 22.43 |
| 114 | Lu(OH)3 | 1.9×10 | 23.72 |
| 115 | Mg3(AsO4)2 | 2.1×10 | 19.68 |
| 116 | MgCO3 | 3.5×10 | 7.46 |
| 117 | MgCO3·3H2O | 2.14×10 | 4.67 |
| 118 | Mg(OH)2 | 1.8×10 | 10.74 |
| 119 | Mg3(PO4)2·8H2O | 6.31×10 | 25.2 |
| 120 | Mn3(AsO4)2 | 1.9×10 | 28.72 |
| 121 | MnCO3 | 1.8×10 | 10.74 |
| 122 | Mn(IO3)2 | 4.37×10 | 6.36 |
| 123 | Mn(OH)4 | 1.9×10 | 12.72 |
| 124 | MnS(粉紅) | 2.5×10 | 9.6 |
| 125 | MnS(綠) | 2.5×10 | 12.6 |
| 126 | Ni3(AsO4)2 | 3.1×10 | 25.51 |
| 127 | NiCO3 | 6.6×10 | 8.18 |
| 128 | NiC2O4 | 4.0×10 | 9.4 |
| 129 | Ni(OH)2(新) | 2.0×10 | 14.7 |
| 130 | Ni3(PO4)2 | 5.0×10 | 30.3 |
| 131 | α-NiS | 3.2×10 | 18.5 |
| 132 | β-NiS | 1.0×10 | 24 |
| 133 | γ-NiS | 2.0×10 | 25.7 |
| 134 | Pb3(AsO4)2 | 4.0×10 | 35.39 |
| 135 | PbBr2 | 4.0×10 | 4.41 |
| 136 | PbCl2 | 1.6×10 | 4.79 |
| 137 | PbCO3 | 7.4×10 | 13.13 |
| 138 | PbCrO4 | 2.8×10 | 12.55 |
| 139 | PbF2 | 2.7×10 | 7.57 |
| 140 | PbMoO4 | 1.0×10 | 13 |
| 141 | Pb(OH)2 | 1.2×10 | 14.93 |
| 142 | Pb(OH)4 | 3.2×10 | 65.49 |
| 143 | Pb3(PO4)3 | 8.0×10 | 42.1 |
| 144 | PbS | 1.0×10 | 28 |
| 145 | PbSO4 | 1.6×10 | 7.79 |
| 146 | PbSe | 7.94×10 | 42.1 |
| 147 | PbSeO4 | 1.4×10 | 6.84 |
| 148 | Pd(OH)2 | 1.0×10 | 31 |
| 149 | Pd(OH)4 | 6.3×10 | 70.2 |
| 150 | PdS | 2.03×10 | 57.69 |
| 151 | Pm(OH)3 | 1.0×10 | 21 |
| 152 | Pr(OH)3 | 6.8×10 | 21.17 |
| 153 | Pt(OH)2 | 1.0×10 | 35 |
| 154 | Pu(OH)3 | 2.0×10 | 19.7 |
| 155 | Pu(OH)4 | 1.0×10 | 55 |
| 156 | RaSO4 | 4.2×10 | 10.37 |
| 157 | Rh(OH)3 | 1.0×10 | 23 |
| 158 | Ru(OH)3 | 1.0×10 | 36 |
| 159 | Sb2S3 | 1.5×10 | 92.8 |
| 160 | ScF3 | 4.2×10 | 17.37 |
| 161 | Sc(OH)3 | 8.0×10 | 30.1 |
| 162 | Sm(OH)3 | 8.2×10 | 22.08 |
| 163 | Sn(OH)2 | 1.4×10 | 27.85 |
| 164 | Sn(OH)4 | 1.0×10 | 56 |
| 165 | SnO2 | 3.98×10 | 64.4 |
| 166 | SnS | 1.0×10 | 25 |
| 167 | SnSe | 3.98×10 | 38.4 |
| 168 | Sr3(AsO4)2 | 8.1×10 | 18.09 |
| 169 | SrCO3 | 1.1×10 | 9.96 |
| 170 | SrC2O4·H2O | 1.6×10 | 6.8 |
| 171 | SrF2 | 2.5×10 | 8.61 |
| 172 | Sr3(PO4)2 | 4.0×10 | 27.39 |
| 173 | SrSO4 | 3.2×10 | 6.49 |
| 174 | SrWO4 | 1.7×10 | 9.77 |
| 175 | Tb(OH)3 | 2.0×10 | 21.7 |
| 176 | Te(OH)4 | 3.0×10 | 53.52 |
| 177 | Th(C2O4)2 | 1.0×10 | 22 |
| 178 | Th(IO3)4 | 2.5×10 | 14.6 |
| 179 | Th(OH)4 | 4.0×10 | 44.4 |
| 180 | Ti(OH)3 | 1.0×10 | 40 |
| 181 | TlBr | 3.4×10 | 5.47 |
| 182 | TlCl | 1.7×10 | 3.76 |
| 183 | Tl2CrO4 | 9.77×10 | 12.01 |
| 184 | TlI | 6.5×10 | 7.19 |
| 185 | TlN3 | 2.2×10 | 3.66 |
| 186 | Tl2S | 5.0×10 | 20.3 |
| 187 | TlSeO3 | 2.0×10 | 38.7 |
| 188 | UO2(OH)2 | 1.1×10 | 21.95 |
| 189 | VO(OH)2 | 5.9×10 | 22.13 |
| 190 | Y(OH)3 | 8.0×10 | 22.1 |
| 191 | Yb(OH)3 | 3.0×10 | 23.52 |
| 192 | Zn3(AsO4)2 | 1.3×10 | 27.89 |
| 193 | ZnCO3 | 1.4×10 | 10.84 |
| 194 | Zn(OH)2 | 2.09×10 | 15.68 |
| 195 | Zn3(PO4)2 | 9.0×10 | 32.04 |
| 196 | α-ZnS | 1.6×10 | 23.8 |
| 197 | β-ZnS | 2.5×10 | 21.6 |
| 198 | ZrO(OH)2 | 6.3×10 | 48.2 |
| ①~③:形態均為無定形。 |
難溶電解質的溶度積常數
| 名稱 | 化學式 | Ksp | 名稱 | 化學式 | Ksp |
| 氯化銀 | AgCl | 1.56×10^-10 | 氫氧化鐵 | Fe(OH)3 | 1.1×10^-36 |
| 溴化銀 | AgBr | 7.7×10^-13 | 硫化鐵 | FeS | 3.7×10^-19 |
| 碘化銀 | AgI | 1.5×10^-16 | 氯化亞汞 | Hg2Cl2 | 2×10^-18 |
| 鉻酸銀 | Ag2CrO4 | 9.0×10^-12 | 溴化亞汞 | Hg2Br2 | 1.3×10^-21 |
| 碳酸鋇 | BaCO3 | 8.1×10^-9 | 碘化亞汞 | Hg2I2 | 1.2×10^-28 |
| 鉻酸鋇 | BaCrO4 | 1.6×10^-10 | 硫化汞 | HgS | 4×10^-53~2×10^-49 |
| 硫酸鋇 | BaSO4 | 1.08×10^-10 | 碳酸鋰 | Li2CO3 | 1.7×10^-3 |
| 碳酸鈣 | CaCO3 | 8.7×10^-9 | 碳酸鎂 | MgCO3 | 2.6×10^-5 |
| 草酸鈣 | CaC2O4 | 2.57×10^-9 | 氫氧化鎂 | Mg(OH)2 | 1.2×10^-11 |
| 氟化鈣 | CaF2 | 3.95×10^-11 | 氫氧化錳 | Mn(OH)2 | 4×10^-14 |
| 硫酸鈣 | CaSO4 | 1.96×10^-4 | 硫化錳 | MnS | 1.4×10^-15 |
| 硫化鎘 | CdS | 3.6×10^-29 | 碳酸鉛 | PbCO3 | 3.3×10^-14 |
| 硫化銅 | CuS | 8.5×10^-45 | 鉻酸鉛 | PbCrO4 | 1.77×10^-14 |
| 硫化亞銅 | Cu2S | 2×10^-47 | 碘化鉛 | PbI2 | 1.39×10^-8 |
| 氯化亞銅 | CuCl | 1.02×10^-6 | 硫酸鉛 | PbSO4 | 1.06×10^-3 |
| 溴化亞銅 | CuBr | 4.15×10^-8 | 硫化鉛 | PbS | 3.4×10^-28 |
| 碘化亞銅 | CuI | 5.06×10^-12 | 氫氧化鋅 | Zn(OH)2 | 1.8×10^-14 |
| 氫氧化亞鐵 | Fe(OH)2 | 1.64×10^-14 | 硫化鋅 | ZnS | 1.2×10^-23 |
其他套用
利用金屬硫化物、氫氧化物、碳酸鹽等溶度積的差異分離金屬離子做定性分析。若往氯化鉛飽和溶液中加入氯化鉀時,溶液中Cl濃度增大,C(Pb )C(Cl )大於氯化鉛的溶度積,這時將有部分離子發生Pb+2Cl =PbCl2 ↓的反應,將過剩的PbCl2沉澱出來,直至兩種離子的濃度冪之積等於氯化鉛的溶度積為止。因此,為使溶解度小的物質完全沉澱,需要加入含有共同離子的電解質。 工業里礦下的工業鹽製造也包含了重要的溶度積知識。

